화학 반응식에서 각 화학식 앞에 위치한 숫자를 의미하며, 1의 경우 생략한다.
다음은 H2와 O2가 반응하여 H2O가 생성되는 반응의 화학 반응식을 나타낸 것이다.
이 화학 반응식에서 각 물질의 계수를 구해보자.
2H2(g)+O2(g)→2H2O(l)
- H2(g)의 계수는 2,
- O2(g)의 계수는 1,
- H2O(l)의 계수는 2이다.
아래의 순서에 따라 화학 반응식을 표기한다.
1. 반응물을 먼저 쓰고, 우측을 향하는 화살표 →를 그린 후 생성물을 쓴다.
반응물이나 생성물이 2가지 이상이면 각 화학식 사이에 +를 표기하며, 계수는 a, b, c와 같은 미지수로 둔다.
2. 반응물과 생성물에 존재하는 각 원자의 종류와 개수가 같도록 화학 반응식의 계수를 맞춘다.
3. 가장 간단한 정수비로 화학 반응식의 계수를 표기하며, 1은 생략한다.
4. 물질의 상태를 표기하는 경우, 각 물질의 화학식 뒤에 표기한다.
N2(g)와 H2(g)가 반응하여 NH3(g)가 생성되는 화학 반응식을 표기해보자.
1. 반응물을 먼저 쓰고, 우측을 향하는 화살표 →를 그린 후 생성물을 쓴다.
반응물이나 생성물이 2가지 이상이면 각 화학식 사이에 +를 표기하며, 계수는 a, b, c와 같은 미지수로 둔다.
aN2+bH2→cNH3
2. 반응물과 생성물에 존재하는 각 원자의 종류와 개수가 같도록 화학 반응식의 계수를 맞춘다.
- N의 개수 맞추기: 2a=c
- H의 개수 맞추기: 2b=3c
따라서 b, c를 a로 나타내면 b=3a, c=2a이다.
3. 가장 간단한 정수비로 화학 반응식의 계수를 표기하며, 1은 생략한다.
a:b:c=a:3a:2a=1:3:2가 가장 간단한 정수비이므로 화학 반응식을 나타내면 아래와 같다.
N2+3H2→2NH3
4. 물질의 상태를 표기하는 경우, 각 물질의 화학식 뒤에 표기한다.
반응물과 생성물이 모두 기체 (g)이므로 아래와 같이 표기한다.
N2(g)+3H2(g)→2NH3(g)
계수비는 소모되는 반응물과 생성되는 생성물의 몰 수 비와 같다.
따라서 반응물의 계수비만큼 반응하여 생성물의 계수비만큼 생성된다.
다음은 N2(g)와 H2(g)가 반응하여 NH3(g)가 생성되는 반응의 화학 반응식이다.
이 화학 반응식의 의미를 알아보자.
N2(g)+3H2(g)→2NH3(g)
화학 반응식에서 계수비 N2:H2:NH3=1:3:2이므로
N2(g) 1mol과 H2(g) 3mol이 반응하여 NH3(g) 2mol이 생성됨을 알 수 있다.
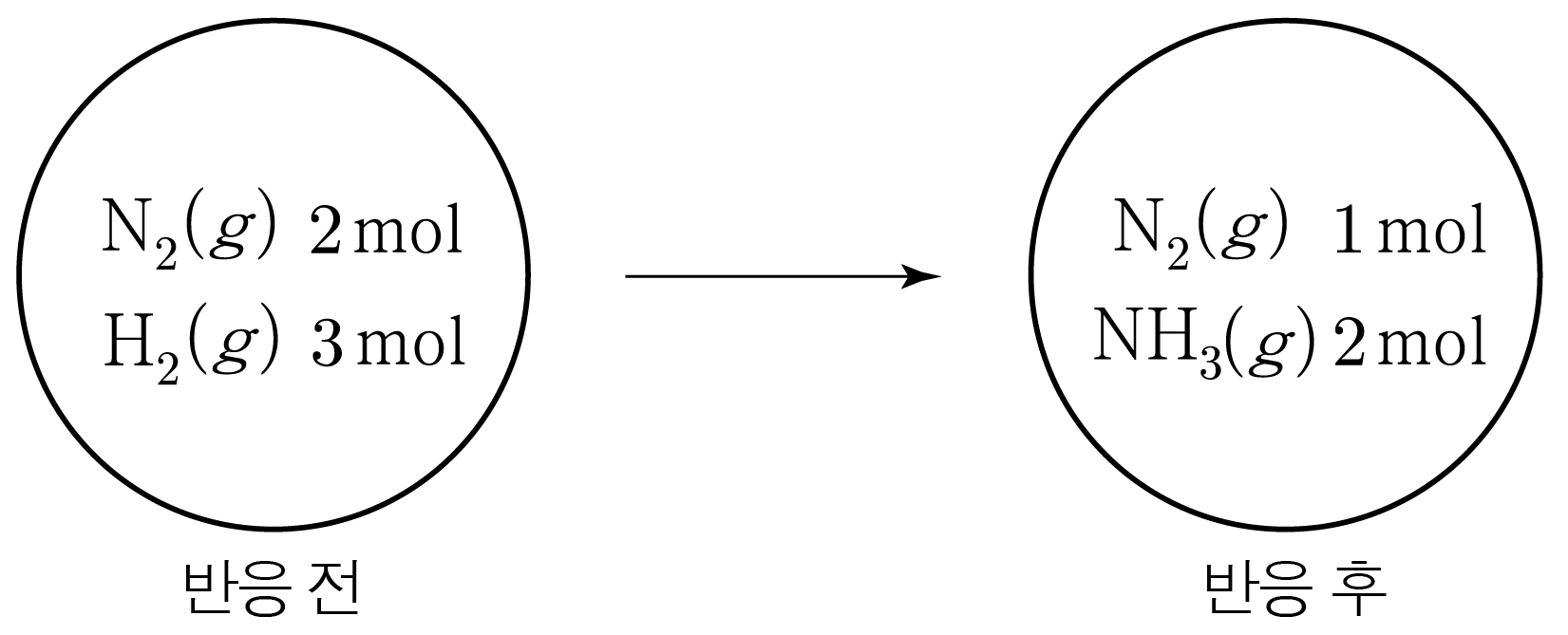
예를 들어 아래 그림과 같이 강철 용기에 N2(g) 2mol과 H2(g) 3mol을 넣고 NH3(g)를 생성하는 반응을 완결시키면
N2(g) 1mol과 H2(g) 3mol이 반응하여 NH3(g) 2mol이 생성되고, N2(g) 1mol이 남는다.
따라서 반응을 정리하면 아래 표와 같다.
| 반응식 |
$\mathrm{N_{2}}(g)$ |
$+$ |
$3\mathrm{H_{2}}(g)$ |
$\rightarrow$ |
$2\mathrm{NH_{3}}(g)$ |
| 반응 전 몰 수 |
$2$ |
|
$3$ |
|
$0$ |
| 반응 몰 수 |
$-1$ |
|
$-3$ |
|
$+2$ |
| 반응 후 몰 수 |
$1$ |
|
$0$ |
|
$2$ |
정답: $3$
반응 전후 각 원소의 원자 개수는 같음을 이용하여 식을 세운다.
- C의 개수 맞추기: 2=b
- H의 개수 맞추기: 4=2c
- O의 개수 맞추기: 2a=2b+c
이를 연립하면 a=3, b=2, c=2이다.
따라서 답은 3번이다.
정답: $5$
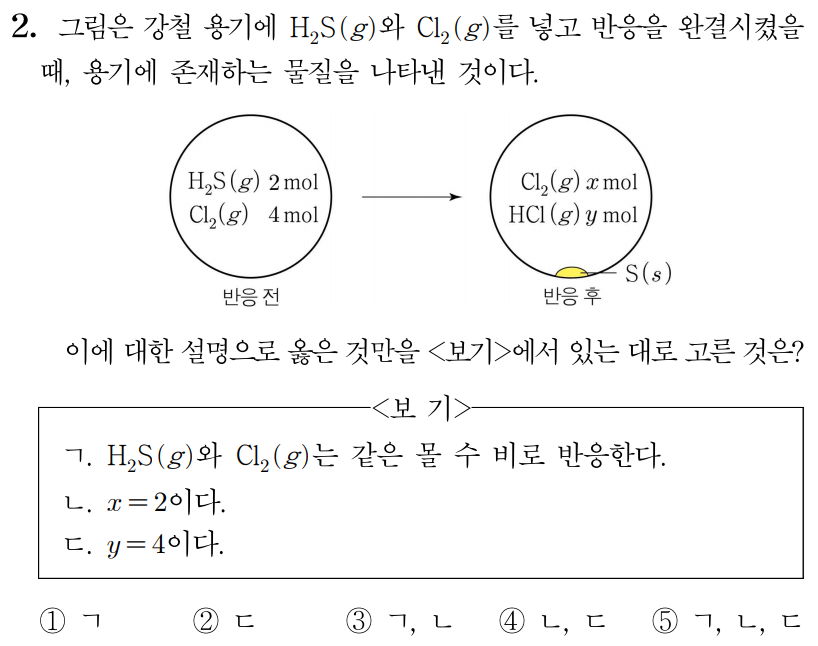
ㄱ. 반응물은 H2S, Cl2, 생성물은 HCl, S이므로 반응식을 세우면 아래와 같다.
aH2S(g)+bCl2(g)→cHCl(g)+dS(s)
반응 전후 각 원소의 원자 개수는 같음을 이용하여 식을 세운다.
- H의 개수 맞추기: 2a=c
- S의 개수 맞추기: a=d
- Cl의 개수 맞추기: 2b=c
이를 연립하여 b, c, d를 a로 나타내면 b=a, c=2a, d=a이므로
가장 간단한 정수비는 a:b:c:d=1:1:2:1이다.
따라서 반응식을 완성하면 다음과 같다.
H2S(g)+Cl2(g)→2HCl(g)+S(s)
이를 통해 H2S(g)와 Cl2(g)는 같은 몰 수 비로 반응함을 알 수 있다. (O)
ㄴ. ㄱ에서 구한 반응식 H2S(g)+Cl2(g)→2HCl(g)+S(s)을 통해 H2S(g)와 Cl2(g)는 1:1의 몰 수 비로 반응하여 HCl(g)와 S(s)가 생성됨을 알 수 있다.
따라서 H2S(g) 2mol과 Cl2(g) 2mol이 반응하여 HCl(g) 4mol과 S(s) 2mol이 생성되므로 반응을 정리하면 아래 표와 같다.
| 반응식 |
$\mathrm{H_{2}S}(g)$ |
$+$ |
$\mathrm{Cl_{2}}(g)$ |
$\rightarrow$ |
$2\mathrm{HCl}(g)$ |
$+$ |
$\mathrm{S}(s)$ |
| 반응 전 몰수 |
$2$ |
|
$4$ |
|
$0$ |
|
$0$ |
| 반응 몰수 |
$-2$ |
|
$-2$ |
|
$+4$ |
|
$+2$ |
| 반응 후 몰수 |
$0$ |
|
$2$ |
|
$4$ |
|
$2$ |
그러므로 x=2이다. (O)
ㄷ. 위에서 구한 표를 통해 y=4임을 알 수 있다. (O)
따라서 답은 5번이다.