25∘C, 1atm(기체인 경우), 1M(수용액인 경우)인 상태이다.
표준 상태를 나타낼 때, 물리량의 기호 뒤에 ∘를 표시한다.
내부 에너지, 압력, 부피를 각각 U, P, V라 할 때, U+PV인 물리량이다.
단위는 주로 kJ/mol을 사용하고, 엔탈피는 기호로 H로 나타낸다.
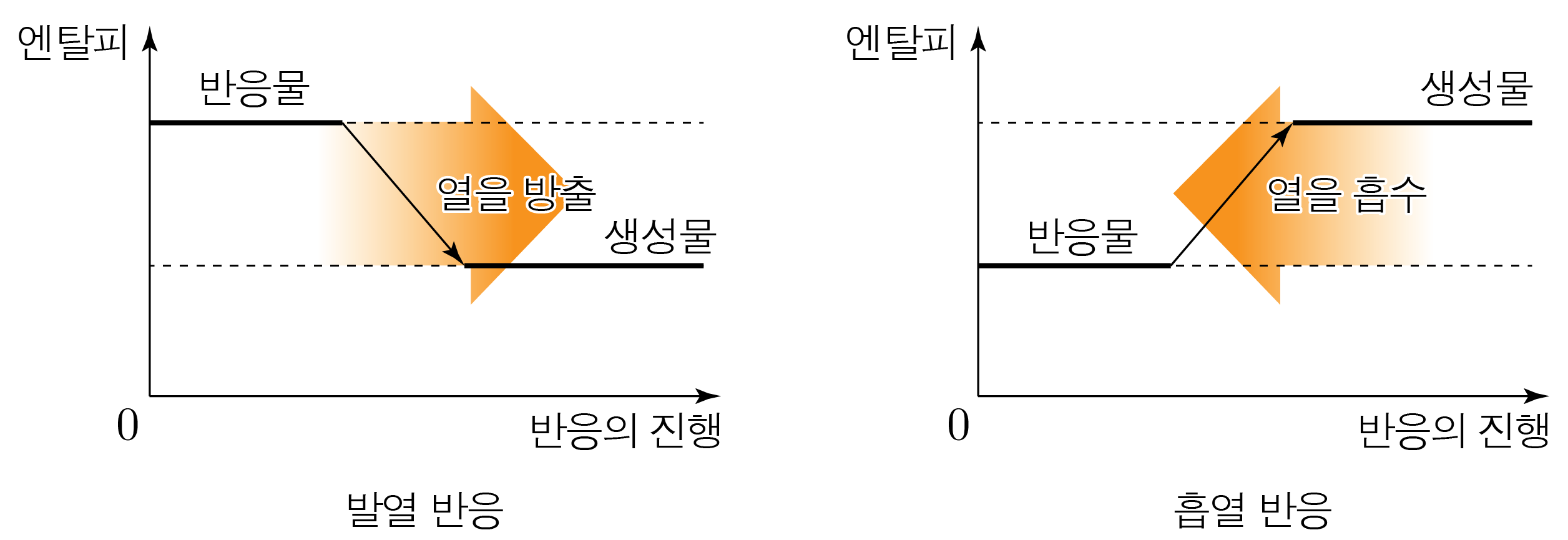
일정한 압력에서 화학 반응이 일어날 때, 생성물과 반응물의 엔탈피 차이(ΔH)이다.
표준 상태의 반응 엔탈피는 기호로 ΔH∘로 나타내고, 표준 반응 엔탈피라 한다.
화학 반응식에서 반응 엔탈피(ΔH)는 (생성물 엔탈피의 합 − 반응물 엔탈피의 합)과 같다.
열을 방출하여 ΔH<0인 화학 반응은 발열 반응, 열을 흡수하여 ΔH>0인 화학 반응은 흡열 반응이다.
반응 엔탈피의 크기(∣ΔH∣)만큼 ΔH<0일 때는 열이 방출되고, ΔH>0일 때는 열이 흡수된다.
발열 반응의 대표적인 예시로 연소 반응이 있다.
화학 반응식과 반응 엔탈피(ΔH)를 함께 나타낸 식이다.
물질의 상태, 온도, 압력에 따라 ΔH가 달라지므로 물질의 상태를 표기하며,
표준 상태가 아닌 경우 온도와 압력을 기재한다.
반응물과 생성물이 서로 반대인 반응(역반응)의 ΔH는 크기가 같고 부호가 반대이다.
다음은 25∘C에서 H2(g)와 O2(g)가 반응하여 H2O(l)가 생성되는 반응의 열화학 반응식이다.
이 열화학 반응식의 의미를 파악하고 역반응의 ΔH∘를 구해보자.
2H2(g)+O2(g)→2H2O(l)ΔH∘=−572kJ
- 열화학 반응식의 의미 파악:
ΔH<0인 화학 반응은 발열 반응이므로 H2(g)와 O2(g)가 반응하여 H2O(l)가 생성되는 반응은 발열 반응이다.
반응 엔탈피의 크기(∣ΔH∣)만큼 열이 방출(ΔH<0일 때)되므로 문제의 열화학 반응식은 표준 상태에서 2mol의 H2(g)와 1mol의 O2(g)가 반응하여 2mol의 H2O(l)가 생성되는 동안 572kJ의 열이 방출됨을 의미한다.
- 역반응의 ΔH∘ 구하기:
역반응의 ΔH∘는 크기가 같고 부호가 반대이므로 열화학 반응식을 나타내면 아래와 같다.
2H2O(l)→2H2(g)+O2(g)ΔH∘=572kJ

정답: $5$
ㄱ. 반응물이 생성물보다 엔탈피가 클 때 발열 반응(ΔH<0인 반응)이 일어나므로 반응물의 엔탈피 합은 생성물의 엔탈피보다 크다.
- 다른 풀이:
화학 반응식에서 반응 엔탈피(ΔH)는 (생성물 엔탈피의 합 − 반응물 엔탈피의 합)과 같고,
ΔH<0이므로 반응물의 엔탈피 합을 H1, 생성물의 엔탈피를 H2라 하면, H2−H1<0, H2<H1이다.
그러므로 반응물의 엔탈피 합은 생성물의 엔탈피보다 크다. (O)
ㄴ. ΔH<0인 화학 반응은 발열 반응이다. (O)
ㄷ. 문제의 열화학 반응식은 1mol의 N2(g)와 3mol의 H2(g)가 반응하여
2mol의 NH3(g)가 생성되는 동안 ΔH∘=−92kJ임을 의미한다.
그러므로 N2(g)와 H2(g)가 반응하여 1mol의 NH3(g)가 생성될 때,
표준 반응 엔탈피 ΔH∘=−92kJ×21=−46kJ이다. (O)
따라서 답은 5번이다.

정답: $1$
반응 전후 각 원소의 원자 개수는 같음을 이용하여 식을 세운다.
C의 개수 맞추기: 1=a
H의 개수 맞추기: 4=2b
O의 개수 맞추기: 4=2a+b
이를 연립하면 a=1, b=2이다.
CxHy의 완전 연소 반응식은 아래와 같다.
CxHy+(x+4y)O2→xCO2+2yH2O
x=1, y=4이므로 a=1, b=2이다.
H2O의 분자량은 1×2+16=18이므로, 생성된 H2O(l)의 몰 수는
18g/mol3.6g=18×103.6×10mol=18036mol=51mol이다.
문제의 열화학 반응식은 1mol의 CH4(g)와 2mol의 O2(g)가 반응하여
1mol의 CO2(g)와 2mol의 H2O(l)가 생성되는 동안 ΔH∘=−890kJ임을 의미한다.
그러므로 생성된 H2O(l)의 몰 수가 1mol일 때, 표준 반응 엔탈피 ΔH∘=−890kJ×21=−445kJ이고,
생성된 H2O(l)의 몰 수가 51mol일 때, 표준 반응 엔탈피 ΔH∘=−445kJ×51=−89kJ이다.
따라서 답은 1번이다.