용질의 질량 용액의 질량 × 100 % 용액의 질량 용질의 질량 × 1 0 0 % % %
그림은 물 950 g 9 5 0 g N a O H N a O H 50 g 5 0 g N a O H ( a q ) N a O H ( a q ) N a O H ( a q ) N a O H ( a q )
N a O H ( a q ) N a O H ( a q ) N a O H N a O H 950 g + 50 g = 1000 g 9 5 0 g + 5 0 g = 1 0 0 0 g
N a O H ( a q ) N a O H ( a q ) 50 g 1000 g × 100 % = 5 100 × 100 % = 5 % 1 0 0 0 g 5 0 g × 1 0 0 % = 1 0 0 5 × 1 0 0 % = 5 %
용질의 몰 수 ( m o l ) 용액의 부피 ( L ) 용액의 부피 ( L ) 용질의 몰 수 ( m o l ) M = m o l / L M = m o l / L
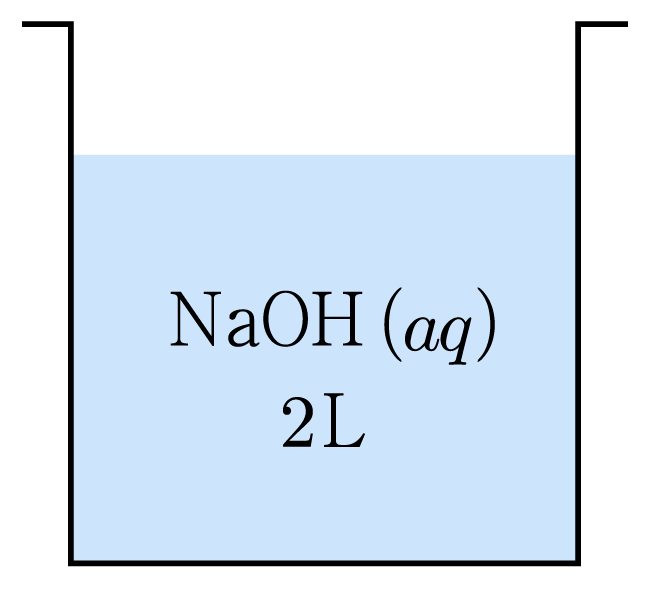
그림은 물에 수산화 나트륨(N a O H N a O H 80 g 8 0 g N a O H ( a q ) N a O H ( a q ) N a O H ( a q ) N a O H ( a q ) 2 L 2 L N a O H ( a q ) N a O H ( a q ) N a O H N a O H 40 g / m o l 4 0 g / m o l
용질의 몰 수는 80 g × 1 m o l 40 g / m o l = 2 m o l 8 0 g × 4 0 g / m o l 1 m o l = 2 m o l 2 L 2 L N a O H ( a q ) N a O H ( a q ) 2 m o l 2 L = 1 m o l / L = 1 M 2 L 2 m o l = 1 m o l / L = 1 M
용질의 몰 수 ( m o l ) 용매의 질량 ( k g ) 용매의 질량 ( k g ) 용질의 몰 수 ( m o l ) m = m o l / k g m = m o l / k g
그림은 물 500 g 5 0 0 g N a O H N a O H 20 g 2 0 g N a O H ( a q ) N a O H ( a q ) N a O H ( a q ) N a O H ( a q ) N a O H N a O H 40 g / m o l 4 0 g / m o l
용질의 몰 수는 20 g × 1 m o l 40 g / m o l = 0.5 m o l 2 0 g × 4 0 g / m o l 1 m o l = 0 . 5 m o l 500 g = 0.5 × 1 0 3 g = 0.5 k g 5 0 0 g = 0 . 5 × 1 0 3 g = 0 . 5 k g N a O H ( a q ) N a O H ( a q ) 0.5 m o l 0.5 k g = 1 m o l / k g = 1 m 0 . 5 k g 0 . 5 m o l = 1 m o l / k g = 1 m
1번 문항 정답 및 해설 보기
정답: $5$
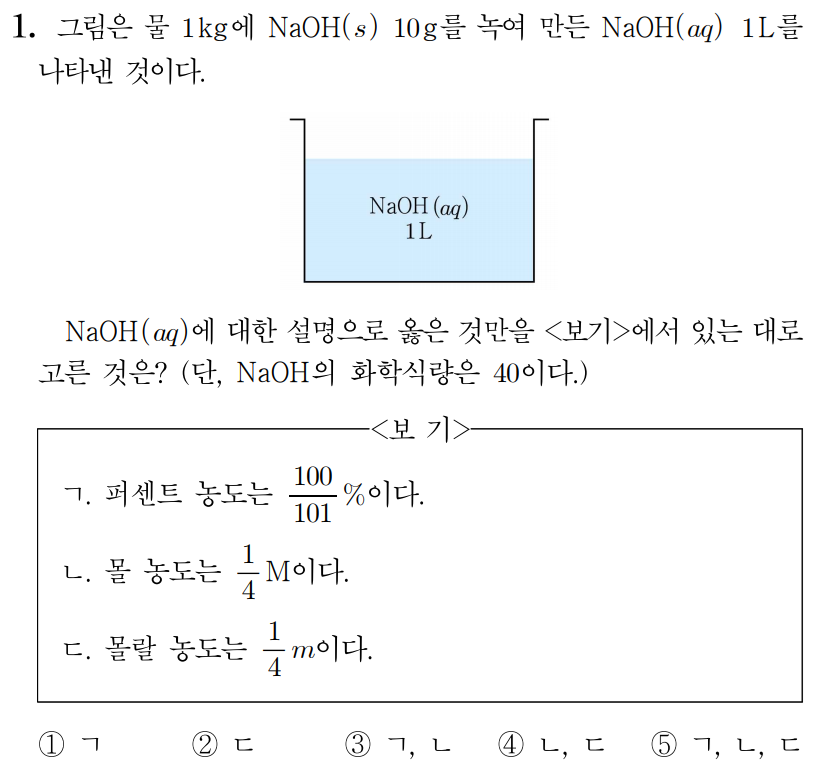
ㄱ. 용질(N a O H ( s ) N a O H ( s ) 10 g 1 0 g 1 k g = 1 × 1 0 3 g = 1000 g 1 k g = 1 × 1 0 3 g = 1 0 0 0 g N a O H ( a q ) N a O H ( a q ) 10 g + 1000 g = 1010 g 1 0 g + 1 0 0 0 g = 1 0 1 0 g 10 g 1010 g × 100 % = 100 101 % 1 0 1 0 g 1 0 g × 1 0 0 % = 1 0 1 1 0 0 %
ㄴ. N a O H N a O H 40 g / m o l 4 0 g / m o l N a O H ( s ) N a O H ( s ) 10 g × 1 m o l 40 g / m o l = 1 4 m o l 1 0 g × 4 0 g / m o l 1 m o l = 4 1 m o l 1 L 1 L 1 4 m o l 1 L = 1 4 m o l / L = 1 4 M 1 L 4 1 m o l = 4 1 m o l / L = 4 1 M
ㄷ. 용질(N a O H ( s ) N a O H ( s ) 1 4 m o l 4 1 m o l 1 k g 1 k g 1 4 m o l 1 k g = 1 4 m o l / k g = 1 4 m 1 k g 4 1 m o l = 4 1 m o l / k g = 4 1 m
따라서 답은 5 5
2번 문항 정답 및 해설 보기
정답: $1$
몰 농도(M M = 용질의 몰 수 ( m o l ) 용액의 부피 ( L ) = 용액의 부피 ( L ) 용질의 몰 수 ( m o l ) M M × × L L = = m o l m o l
따라서 a M N a O H ( a q ) 1 L a M N a O H ( a q ) 1 L a M × 1 L = a m o l / L × 1 L = a m o l a M × 1 L = a m o l / L × 1 L = a m o l N a O H N a O H 0.5 M N a O H ( a q ) 2 L 0 . 5 M N a O H ( a q ) 2 L 0.5 M × 2 L = 0.5 m o l / L × 2 L = 1 m o l 0 . 5 M × 2 L = 0 . 5 m o l / L × 2 L = 1 m o l N a O H N a O H 2 M N a O H ( a q ) 1 L 2 M N a O H ( a q ) 1 L 2 M × 1 L = 2 m o l / L × 1 L = 2 m o l 2 M × 1 L = 2 m o l / L × 1 L = 2 m o l N a O H N a O H
앞서 구한 내용을 바탕으로 각 용액에 포함되어 있는 N a O H N a O H
구분
초기 상태
(가)
(나)
$\mathrm{NaOH}$의 몰 수
$a\,\mathrm{mol}$
$(a+1)\,\mathrm{mol}$
$(a+1+2)\,\mathrm{mol}$
부피
$1\,\mathrm{L}$
$1\,\mathrm{L}+2\,\mathrm{L}=3\,\mathrm{L}$
$3\,\mathrm{L}+1\,\mathrm{L}=4\,\mathrm{L}$
ㄱ. (가)의 몰 농도는 1 M 1 M ( a + 1 ) m o l 3 L = ( a + 1 ) 3 M = 1 M , 3 L ( a + 1 ) m o l = 3 ( a + 1 ) M = 1 M , a + 1 = 3 , a + 1 = 3 , a = 2 a = 2
ㄴ. (가)에 녹아있는 용질(N a O H N a O H ( a + 1 ) m o l = 3 m o l ( a + 1 ) m o l = 3 m o l N a O H N a O H 40 g / m o l 4 0 g / m o l 3 m o l × 40 g / m o l = 120 g 3 m o l × 4 0 g / m o l = 1 2 0 g
ㄷ. a = 2 a = 2 ( a + 1 + 2 ) m o l 4 L = 5 m o l 4 L = 5 4 M 4 L ( a + 1 + 2 ) m o l = 4 L 5 m o l = 4 5 M
따라서 답은 1 1