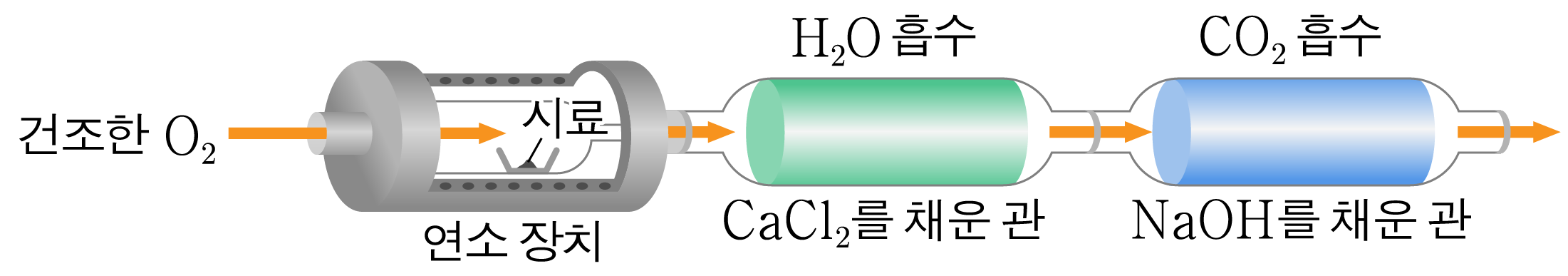
분석에 쓰이는 물질이나 생물이다.
물질이 산소(O 2 O 2
생성물이 C O 2 C O 2 H 2 O H 2 O
C x H y C x H y C x H y C x H y O 2 O 2 C O 2 C O 2 H 2 O H 2 O
C x H y + ( x + y 4 ) O 2 → x C O 2 + y 2 H 2 O C x H y + ( x + 4 y ) O 2 → x C O 2 + 2 y H 2 O
C x H y O z C x H y O z C x H y O z C x H y O z O 2 O 2 C O 2 C O 2 H 2 O H 2 O
C x H y O z + ( x + y 4 − z 2 ) O 2 → x C O 2 + y 2 H 2 O C x H y O z + ( x + 4 y − 2 z ) O 2 → x C O 2 + 2 y H 2 O
생성물에 C C C O C O
C a C l 2 C a C l 2 H 2 O H 2 O N a O H N a O H C O 2 C O 2
충분한 양의 O 2 O 2 C O 2 C O 2 H 2 O H 2 O
C a C l 2 C a C l 2 H 2 O H 2 O N a O H N a O H C O 2 C O 2
흡수된 H 2 O H 2 O H H C O 2 C O 2 C C H H C C
연소 장치에 넣는 O 2 O 2 H 2 O H 2 O C a C l 2 C a C l 2 H 2 O H 2 O H H O 2 O 2 H 2 O H 2 O O 2 O 2
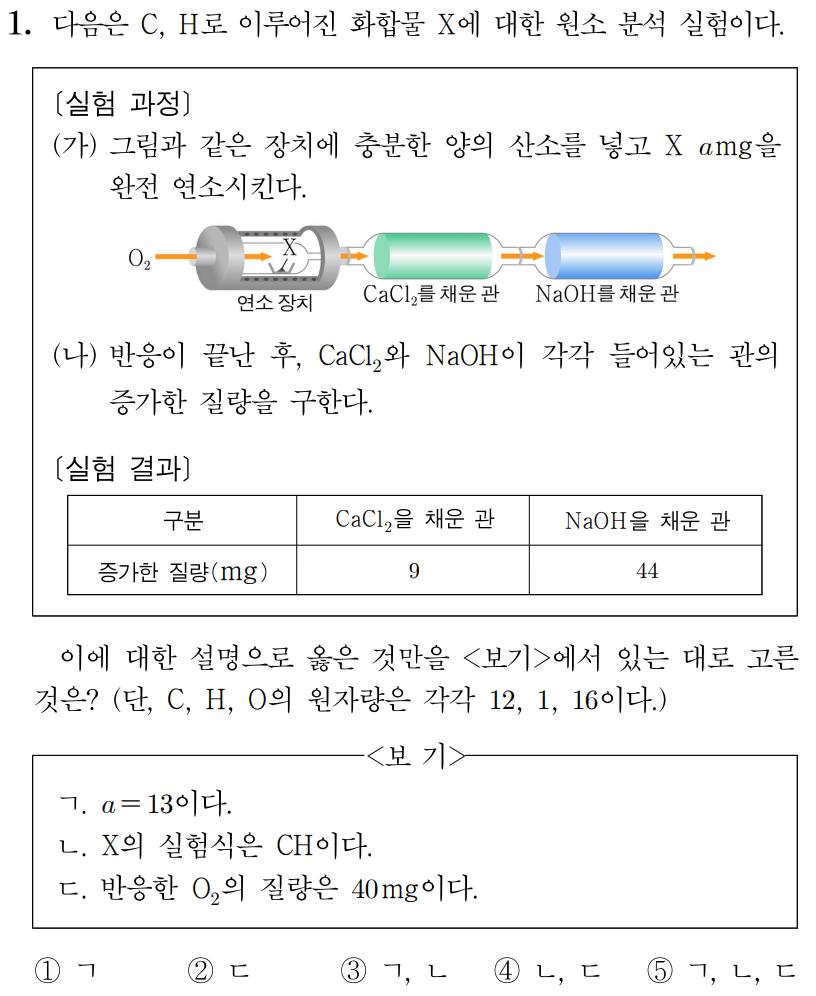
그림과 같은 장치에 충분한 양의 산소(O 2 O 2 C C H H X X a m g a m g C a C l 2 C a C l 2 N a O H N a O H 18 m g 1 8 m g 44 m g 4 4 m g a a X X C C H H O O 12 1 2 1 1 16 1 6
C a C l 2 C a C l 2 C a C l 2 C a C l 2 H 2 O H 2 O
H 2 O H 2 O ( 1 × 2 + 16 ) g / m o l = 18 g / m o l ( 1 × 2 + 1 6 ) g / m o l = 1 8 g / m o l H 2 O H 2 O 18 m g × 1 18 g / m o l = 1 m m o l 1 8 m g × 1 8 g / m o l 1 = 1 m m o l H H 1 m m o l × 2 = 2 m m o l 1 m m o l × 2 = 2 m m o l
또한 H H 1 g / m o l 1 g / m o l H H 2 m m o l × 1 g / m o l = 2 m g 2 m m o l × 1 g / m o l = 2 m g
흡수된 H 2 O H 2 O H H X X H H 2 m g 2 m g N a O H N a O H N a O H N a O H C O 2 C O 2
C O 2 C O 2 ( 12 + 16 × 2 ) g / m o l = 44 g / m o l ( 1 2 + 1 6 × 2 ) g / m o l = 4 4 g / m o l C O 2 C O 2 44 m g × 1 44 g / m o l = 1 m m o l 4 4 m g × 4 4 g / m o l 1 = 1 m m o l C C 1 m m o l 1 m m o l
또한 C C 12 g / m o l 1 2 g / m o l C C 1 m m o l × 12 g / m o l = 12 m g 1 m m o l × 1 2 g / m o l = 1 2 m g C O 2 C O 2 C C X X C C 12 m g 1 2 m g
X X C C H H a = 12 m g + 2 m g = 14 m g a = 1 2 m g + 2 m g = 1 4 m g
시료에서 C C H H 1 m m o l , 1 m m o l , 2 m m o l 2 m m o l C C H H 1 : 2 1 : 2 X X C H 2 C H 2
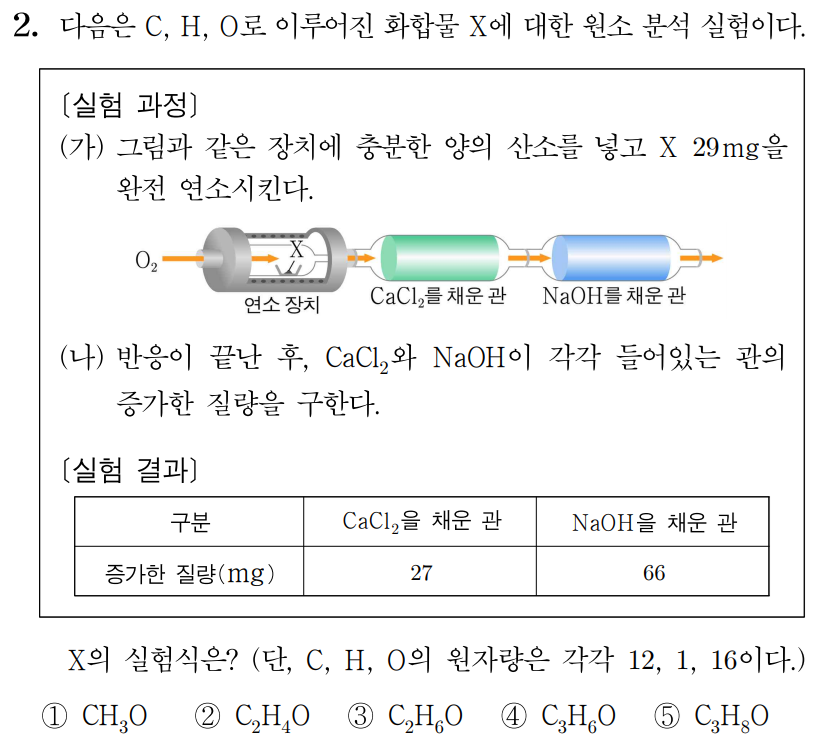
그림과 같은 장치에 충분한 양의 산소(O 2 O 2 C C H H O O X X 29 m g 2 9 m g C a C l 2 C a C l 2 N a O H N a O H 9 m g 9 m g 44 m g 4 4 m g X X C C H H O O 12 1 2 1 1 16 1 6
C a C l 2 C a C l 2 C a C l 2 C a C l 2 H 2 O H 2 O
H 2 O H 2 O ( 1 × 2 + 16 ) g / m o l = 18 g / m o l ( 1 × 2 + 1 6 ) g / m o l = 1 8 g / m o l H 2 O H 2 O 9 m g × 1 18 g / m o l = 0.5 m m o l 9 m g × 1 8 g / m o l 1 = 0 . 5 m m o l H H 0.5 m m o l × 2 = 1 m m o l 0 . 5 m m o l × 2 = 1 m m o l
또한 H H 1 g / m o l 1 g / m o l H H 1 m m o l × 1 g / m o l = 1 m g 1 m m o l × 1 g / m o l = 1 m g
흡수된 H 2 O H 2 O H H X X H H 1 m g 1 m g N a O H N a O H N a O H N a O H C O 2 C O 2
C O 2 C O 2 ( 12 + 16 × 2 ) g / m o l = 44 g / m o l ( 1 2 + 1 6 × 2 ) g / m o l = 4 4 g / m o l C O 2 C O 2 44 m g × 1 44 g / m o l = 1 m m o l 4 4 m g × 4 4 g / m o l 1 = 1 m m o l C C 1 m m o l 1 m m o l
또한 C C 12 g / m o l 1 2 g / m o l C C 1 m m o l × 12 g / m o l = 12 m g 1 m m o l × 1 2 g / m o l = 1 2 m g C O 2 C O 2 C C X X C C 12 m g 1 2 m g
X X C C H H O O 29 m g 2 9 m g O O 29 m g − 1 m g − 12 m g = 16 m g 2 9 m g − 1 m g − 1 2 m g = 1 6 m g
O O 16 g / m o l 1 6 g / m o l O O 16 m g × 1 16 g / m o l = 1 m m o l 1 6 m g × 1 6 g / m o l 1 = 1 m m o l
시료에서 C C H H O O 1 m m o l , 1 m m o l , 1 m m o l , 1 m m o l , 1 m m o l 1 m m o l C C H H O O 1 : 1 : 1 1 : 1 : 1 X X C H O C H O
1번 문항 정답 및 해설 보기
정답: $5$
ㄱ. C a C l 2 C a C l 2 C a C l 2 C a C l 2 H 2 O H 2 O
H 2 O H 2 O ( 1 × 2 + 16 ) g / m o l = 18 g / m o l ( 1 × 2 + 1 6 ) g / m o l = 1 8 g / m o l H 2 O H 2 O 9 m g × 1 18 g / m o l = 0.5 m m o l 9 m g × 1 8 g / m o l 1 = 0 . 5 m m o l H H 0.5 m m o l × 2 = 1 m m o l 0 . 5 m m o l × 2 = 1 m m o l
또한 H H 1 g / m o l 1 g / m o l H H 1 m m o l × 1 g / m o l = 1 m g 1 m m o l × 1 g / m o l = 1 m g H 2 O H 2 O H H X X H H 1 m g 1 m g N a O H N a O H N a O H N a O H C O 2 C O 2
C O 2 C O 2 ( 12 + 16 × 2 ) g / m o l = 44 g / m o l ( 1 2 + 1 6 × 2 ) g / m o l = 4 4 g / m o l C O 2 C O 2 44 m g × 1 44 g / m o l = 1 m m o l 4 4 m g × 4 4 g / m o l 1 = 1 m m o l C C 1 m m o l 1 m m o l
또한 C C 12 g / m o l 1 2 g / m o l C C 1 m m o l × 12 g / m o l = 12 m g 1 m m o l × 1 2 g / m o l = 1 2 m g C O 2 C O 2 C C X X C C 12 m g 1 2 m g
X X C C H H a = 12 m g + 1 m g = 13 m g a = 1 2 m g + 1 m g = 1 3 m g
ㄴ. 시료에서 C C H H 1 m m o l , 1 m m o l , 1 m m o l 1 m m o l C C H H 1 : 1 1 : 1 X X C H C H
ㄷ. X X C H C H X X C x H x C x H x ( 1 + 12 ) × x g / m o l = 13 x g / m o l ( 1 + 1 2 ) × x g / m o l = 1 3 x g / m o l X X 13 m g × 1 13 x g / m o l = 1 x m m o l 1 3 m g × 1 3 x g / m o l 1 = x 1 m m o l
또한 완전 연소 화학 반응식C x H x + ( x + x 4 ) O 2 → x C O 2 + x 2 H 2 O C x H x + ( x + 4 x ) O 2 → x C O 2 + 2 x H 2 O C x H x + 5 x 4 O 2 → x C O 2 + x 2 H 2 O , C x H x + 4 5 x O 2 → x C O 2 + 2 x H 2 O , 4 C x H x + 5 x O 2 → 4 x C O 2 + 2 x H 2 O 4 C x H x + 5 x O 2 → 4 x C O 2 + 2 x H 2 O
C x H x C x H x 1 x m m o l x 1 m m o l O 2 O 2 1 x m m o l × 5 x 4 = 5 4 m m o l x 1 m m o l × 4 5 x = 4 5 m m o l
이때 O 2 O 2 ( 16 × 2 ) g / m o l = 32 g / m o l ( 1 6 × 2 ) g / m o l = 3 2 g / m o l O 2 O 2 5 4 m m o l × 32 g / m o l = 40 m g 4 5 m m o l × 3 2 g / m o l = 4 0 m g
따라서 답은 5 5
2번 문항 정답 및 해설 보기
정답: $4$
C a C l 2 C a C l 2 C a C l 2 C a C l 2 H 2 O H 2 O
H 2 O H 2 O ( 1 × 2 + 16 ) g / m o l = 18 g / m o l ( 1 × 2 + 1 6 ) g / m o l = 1 8 g / m o l H 2 O H 2 O 27 m g × 1 18 g / m o l = 1.5 m m o l 2 7 m g × 1 8 g / m o l 1 = 1 . 5 m m o l H H 1.5 m m o l × 2 = 3 m m o l 1 . 5 m m o l × 2 = 3 m m o l
또한 H H 1 g / m o l 1 g / m o l H H 3 m m o l × 1 g / m o l = 3 m g 3 m m o l × 1 g / m o l = 3 m g H 2 O H 2 O H H X X H H 3 m g 3 m g N a O H N a O H N a O H N a O H C O 2 C O 2
C O 2 C O 2 ( 12 + 16 × 2 ) g / m o l = 44 g / m o l ( 1 2 + 1 6 × 2 ) g / m o l = 4 4 g / m o l C O 2 C O 2 66 m g × 1 44 g / m o l = 1.5 m m o l 6 6 m g × 4 4 g / m o l 1 = 1 . 5 m m o l C C 1.5 m m o l 1 . 5 m m o l
또한 C C 12 g / m o l 1 2 g / m o l C C 1.5 m m o l × 12 g / m o l = 18 m g 1 . 5 m m o l × 1 2 g / m o l = 1 8 m g C O 2 C O 2 C C X X C C 18 m g 1 8 m g
X X C C H H O O 29 m g 2 9 m g O O 29 m g − 3 m g − 18 m g = 8 m g 2 9 m g − 3 m g − 1 8 m g = 8 m g
이때 O O 16 g / m o l 1 6 g / m o l O O 8 m g × 1 16 g / m o l = 0.5 m m o l 8 m g × 1 6 g / m o l 1 = 0 . 5 m m o l
시료에서 C C H H O O 1.5 m m o l , 1 . 5 m m o l , 3 m m o l , 3 m m o l , 0.5 m m o l 0 . 5 m m o l C C H H O O 1.5 : 3 : 0.5 = 3 : 6 : 1 1 . 5 : 3 : 0 . 5 = 3 : 6 : 1 X X C 3 H 6 O C 3 H 6 O
따라서 답은 4 4