¶ 지식 정보
¶ 전자 부족 원소
와 같이 최외각 전자가 개보다 적어도 안정해질 수 있는 원소이다.
는 최외각 전자가 개일 때 안정하고, 개의 최외각 전자를 가지고 있으므로
안정해지기 위해 개의 공유 전자쌍을 형성하려는 경향이 있다.
¶ 확장된 옥텟 규칙
, , 과 같이 주기 이상의 원소는 오비탈을 사용할 수 있으므로
최외각 전자가 개를 초과하더라도 안정해질 수 있다.
확장된 옥텟 규칙에 의해 개가 개와 결합하여 를 형성하거나,
개가 개와 결합하여 를 형성하는 것이 가능하다.
¶ 결합수
한 원자에 결합한 다른 원자의 개수이다.
단일 결합, 이중 결합, 삼중 결합 모두 각각 개의 결합수를 가진다.
결합 차수와 헷갈리지 않도록 주의한다.
¶ 결합수 예시
그림은 의 루이스 구조를 나타낸 것이다. 에서 의 결합수를 구해보자.
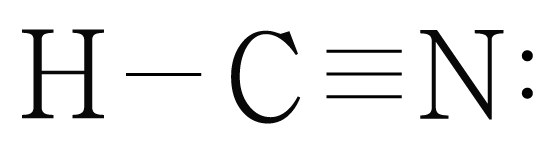
는 개, 개와 결합하고 있으므로 결합수는 개이다.
¶ 분자의 3차원 구조 그리기
분자의 차원 구조를 쐐기와 점선을 통해 평면에 나타낼 수 있다.
기존에 결합을 표현하는 직선 대신 관찰자 쪽으로 튀어나온 부분은 쐐기를,
관찰자 반대 쪽으로 들어간 부분은 쐐기 점선 또는 점선을 통해 나타낸다.

¶ 분자의 3차원 구조 그리기 예시
그림과 같은 분자 구조가 있을 때, 이를 쐐기와 점선을 통해 나타내보자.
주황색 공은 를, 검은색 공은 (원자 번호가 인 원소)를, 초록색 구름은 비공유 전자쌍이 차지하는 공간을 나타낸다.
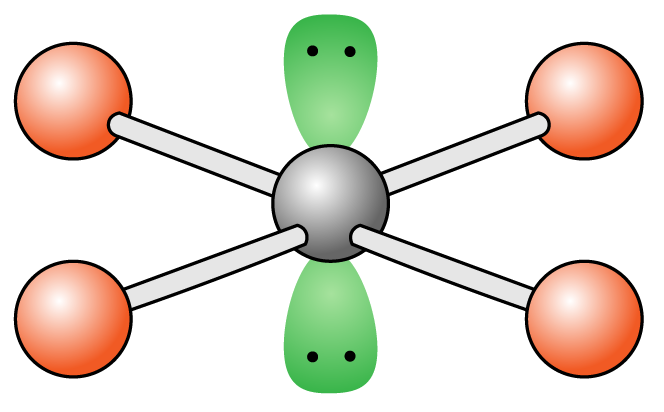
위 그림에서 아래쪽에 위치한 주황색 공은 관찰자 앞쪽으로 튀어나와 있으므로 쐐기를 활용하고,
위쪽에 위치한 주황색 공은 관찰자 반대 쪽으로 들어가 있으므로 점선을 활용한다.
따라서 이 분자의 차원 구조를 그리면 아래 그림과 같다.
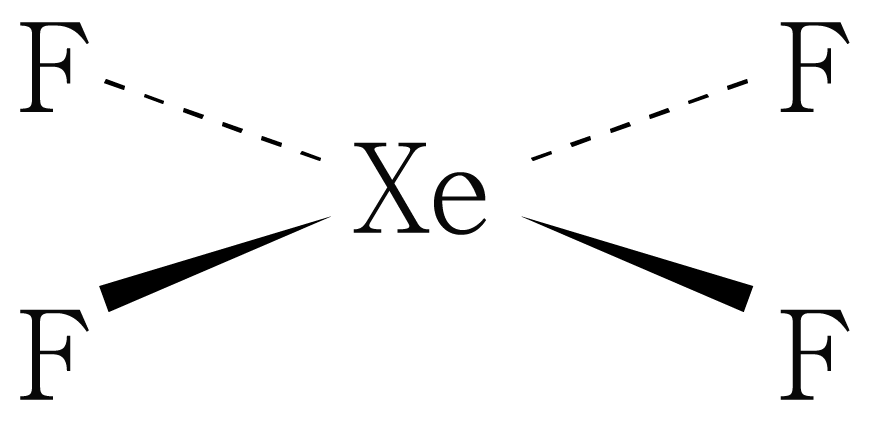
비공유 전자쌍은 생략하였다.
¶ VSEPR(원자가껍질 전자쌍 반발) 이론
중심 원자의 결합수와 비공유 전자쌍 수를 통해 분자의 차원 구조를 예측하는 이론이다.
전자는 음()전하를 띠기 때문에 비공유 전자쌍과 결합 전자쌍은 서로 밀어내며,
이를 최소화하기 위해 전자쌍은 최대한 멀리 떨어지려고 한다.
중심 원자의 결합수와 비공유 전자쌍 수에 따른 분자의 차원 구조는 아래 그림과 같다:
- 결합수가 개, 비공유 전자쌍이 개일 때:
결합각은 이고, 선형 구조이다.

- 결합수가 개, 비공유 전자쌍이 개일 때:
결합각은 이고, 평면 삼각형 구조이다.
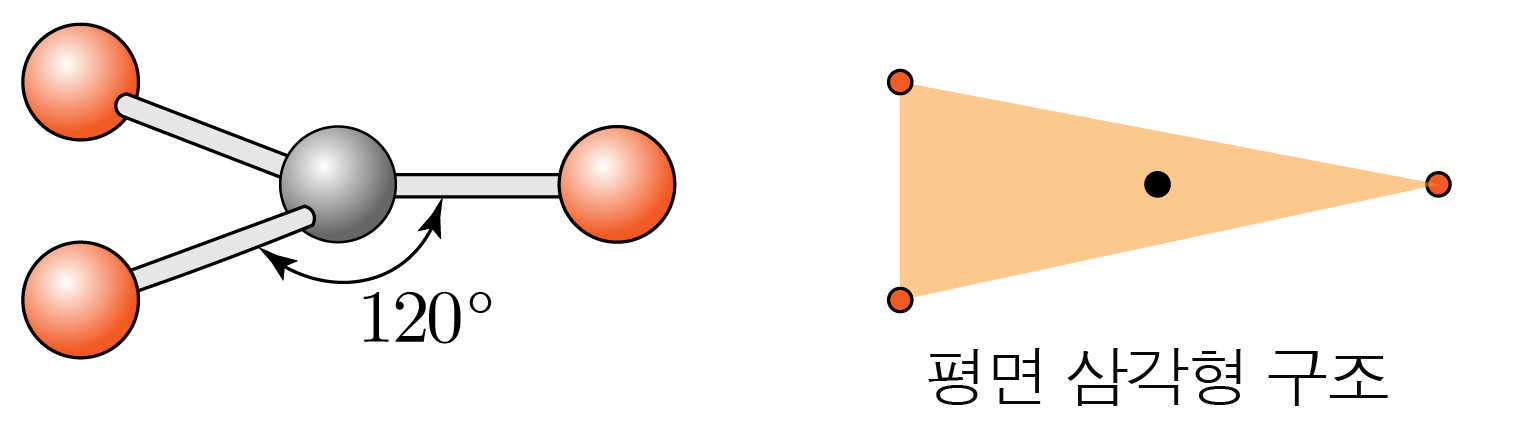
- 결합수가 개, 비공유 전자쌍이 개일 때:
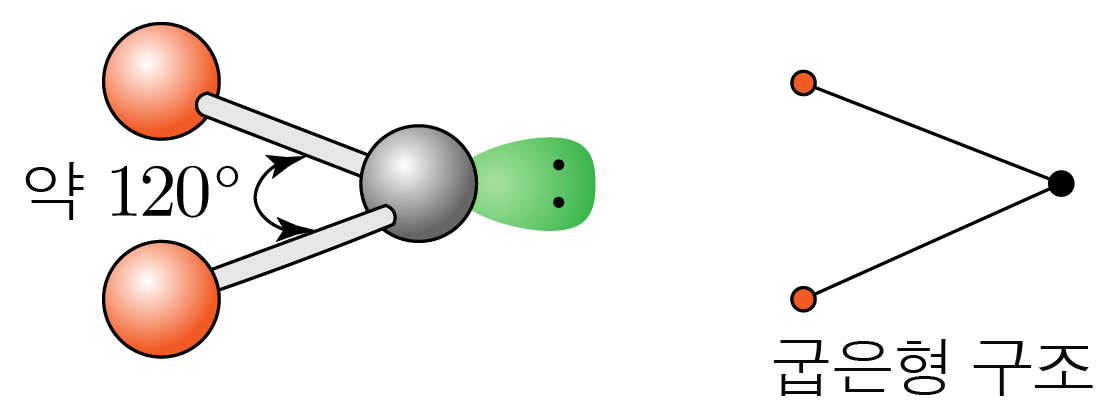
결합각은 약 이고, 굽은형 구조이다.
- 결합수가 개, 비공유 전자쌍이 개일 때:
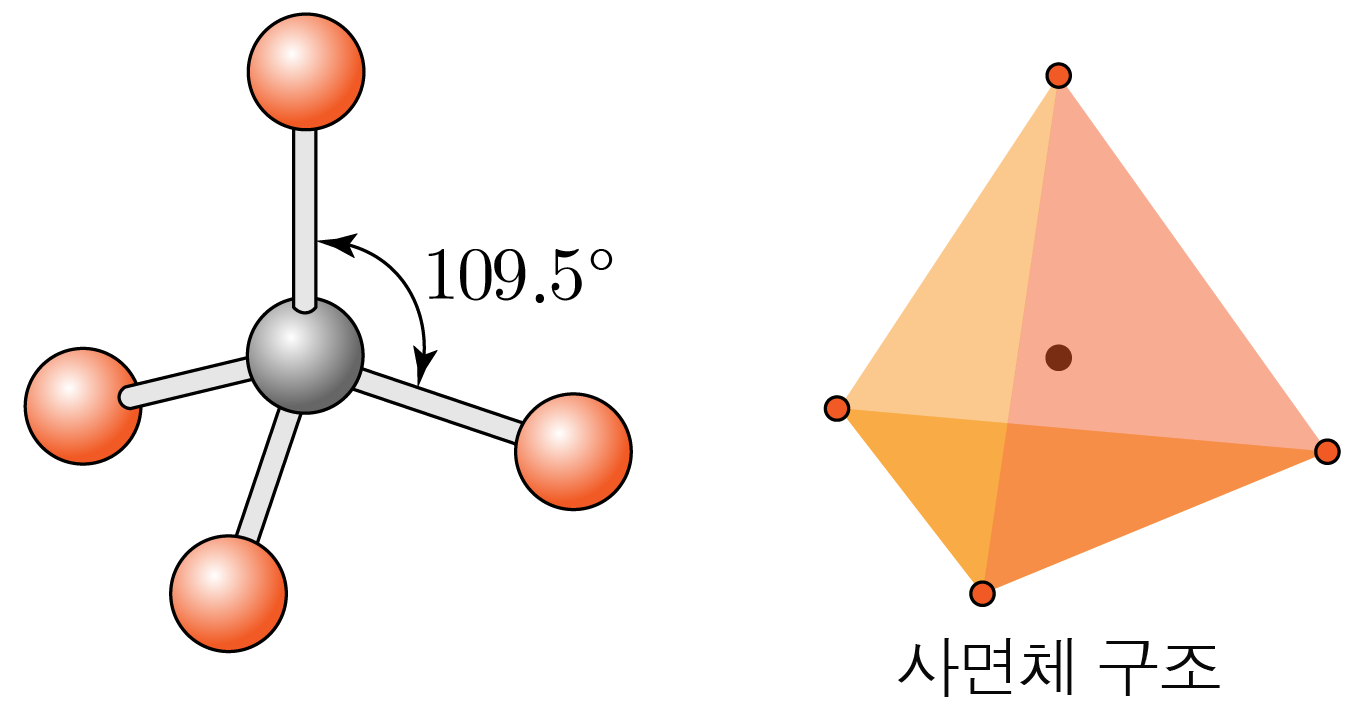
결합각은 이고, 사면체 구조이다.
- 결합수가 개, 비공유 전자쌍이 개일 때:
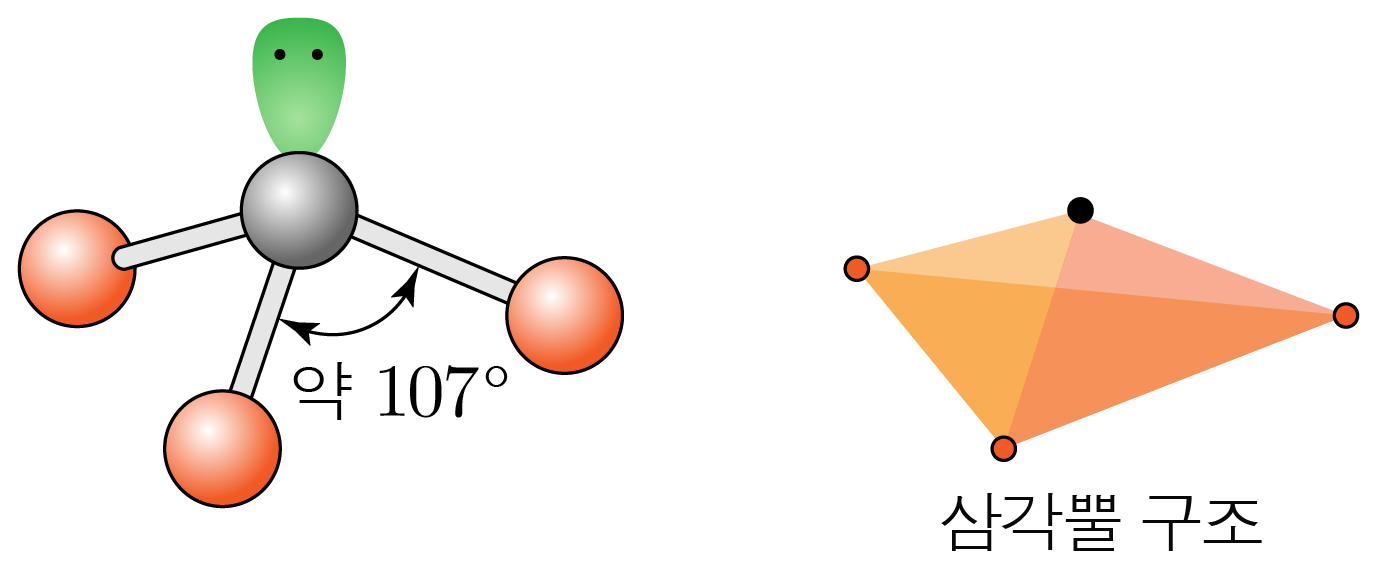
결합각은 약 이고, 삼각뿔 구조이다.
- 결합수가 개, 비공유 전자쌍이 개일 때:
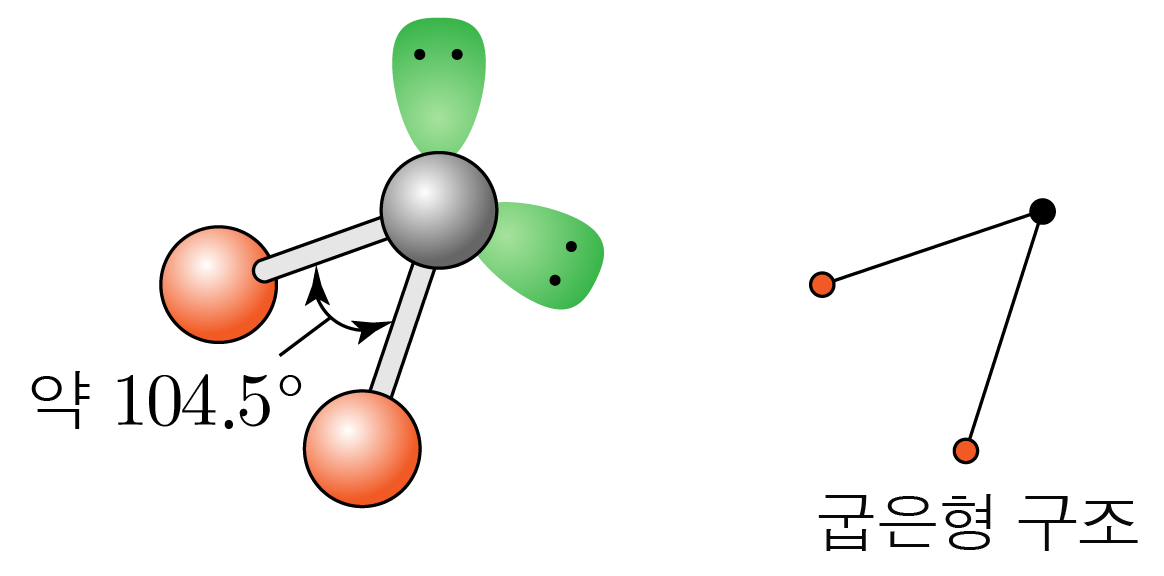
결합각은 약 이고, 굽은형 구조이다.
- 결합수가 개, 비공유 전자쌍이 개일 때:
수평면에서 결합각은 이고, 수평면과 수직 방향의 결합각은 이다.
삼각쌍뿔 구조이다.
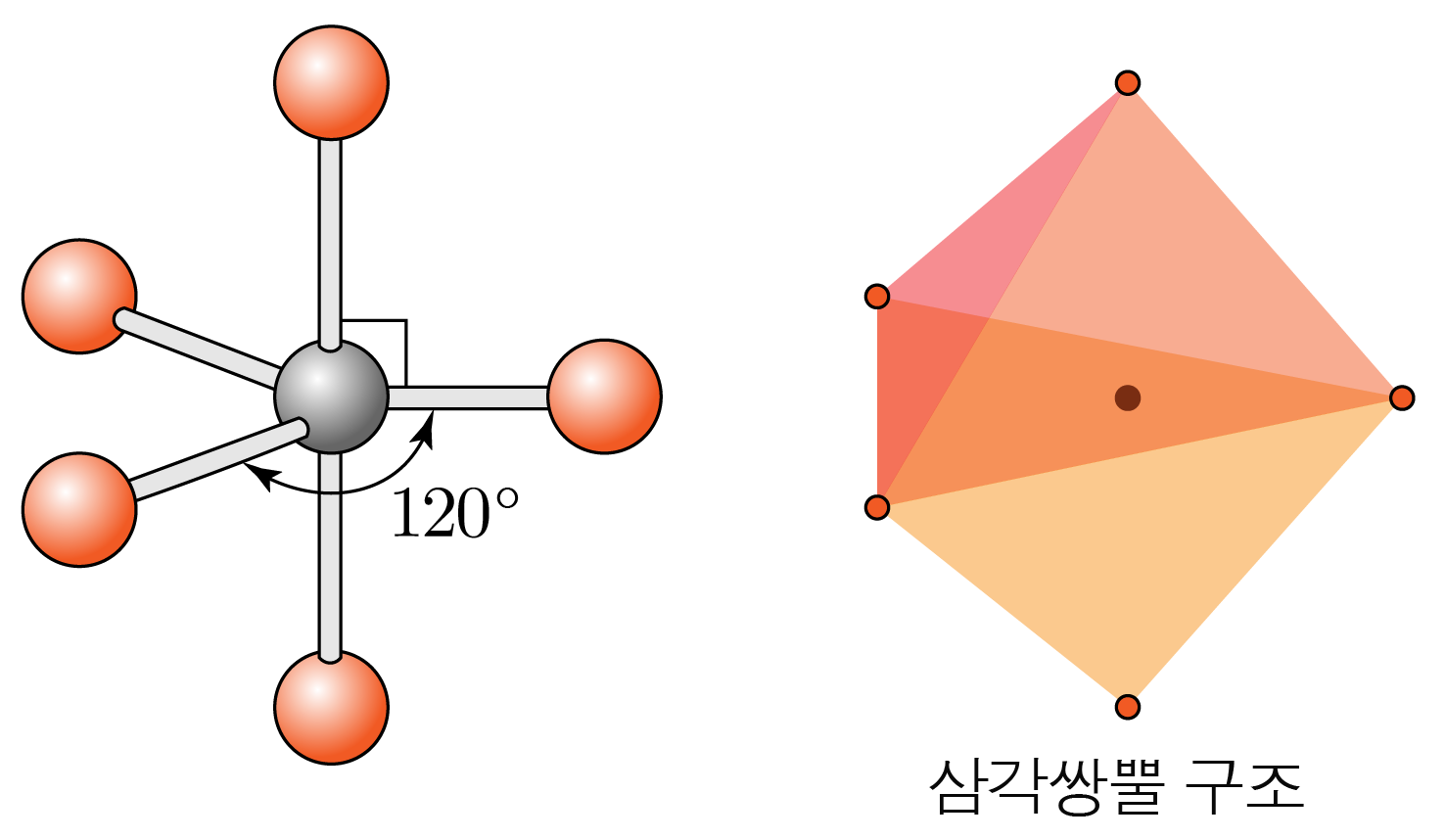
- 결합수가 개, 비공유 전자쌍이 개일 때:
수평면에서 결합각은 약 이고, 수평면과 수직 방향의 결합각은 약 이다.
시소형 구조이다.
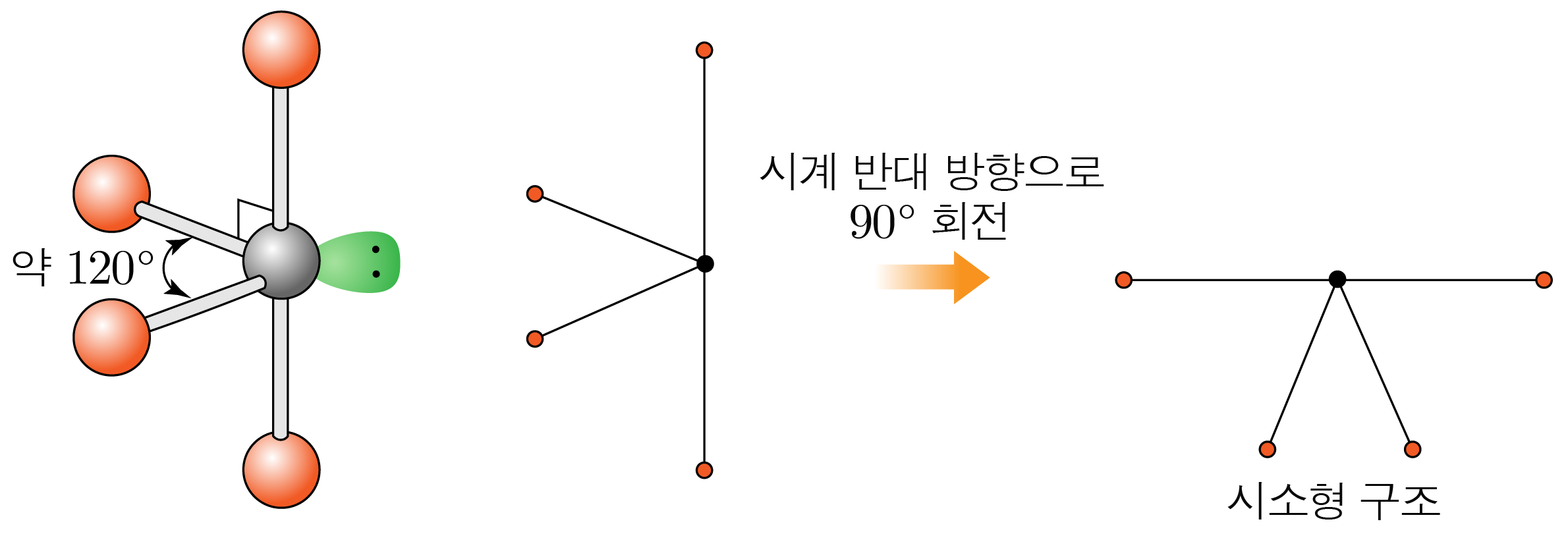
- 결합수가 개, 비공유 전자쌍이 개일 때:
결합각은 약 이고, 자형 구조이다.
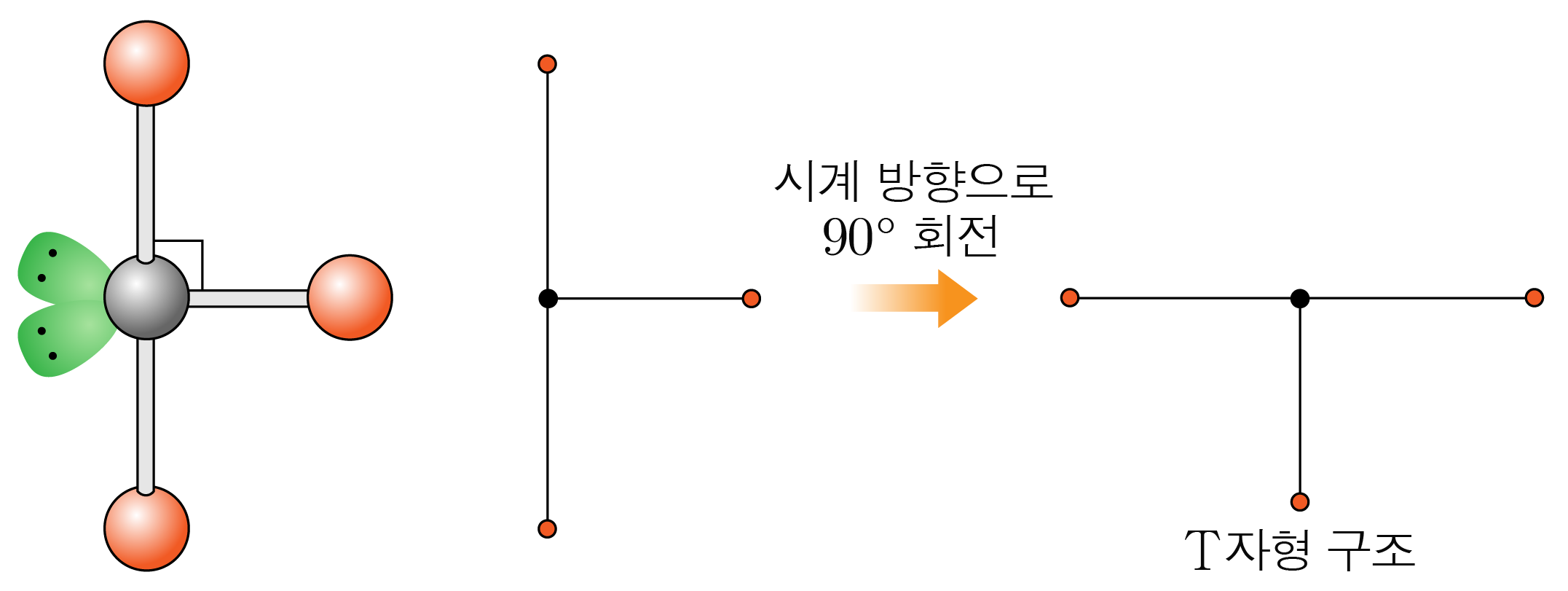
- 결합수가 개, 비공유 전자쌍이 개일 때:
결합각은 이고, 선형 구조이다.
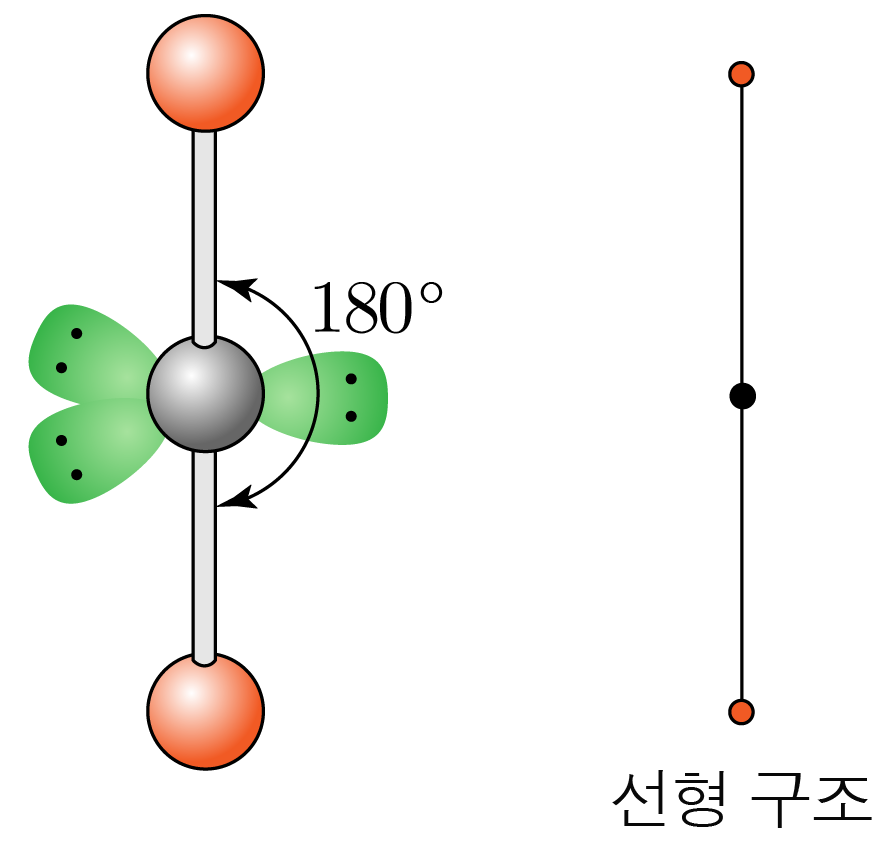
- 결합수가 개, 비공유 전자쌍이 개일 때:
수평면에서 결합각은 이고, 수평면과 수직 방향의 결합각은 이다.
팔면체 구조이다.
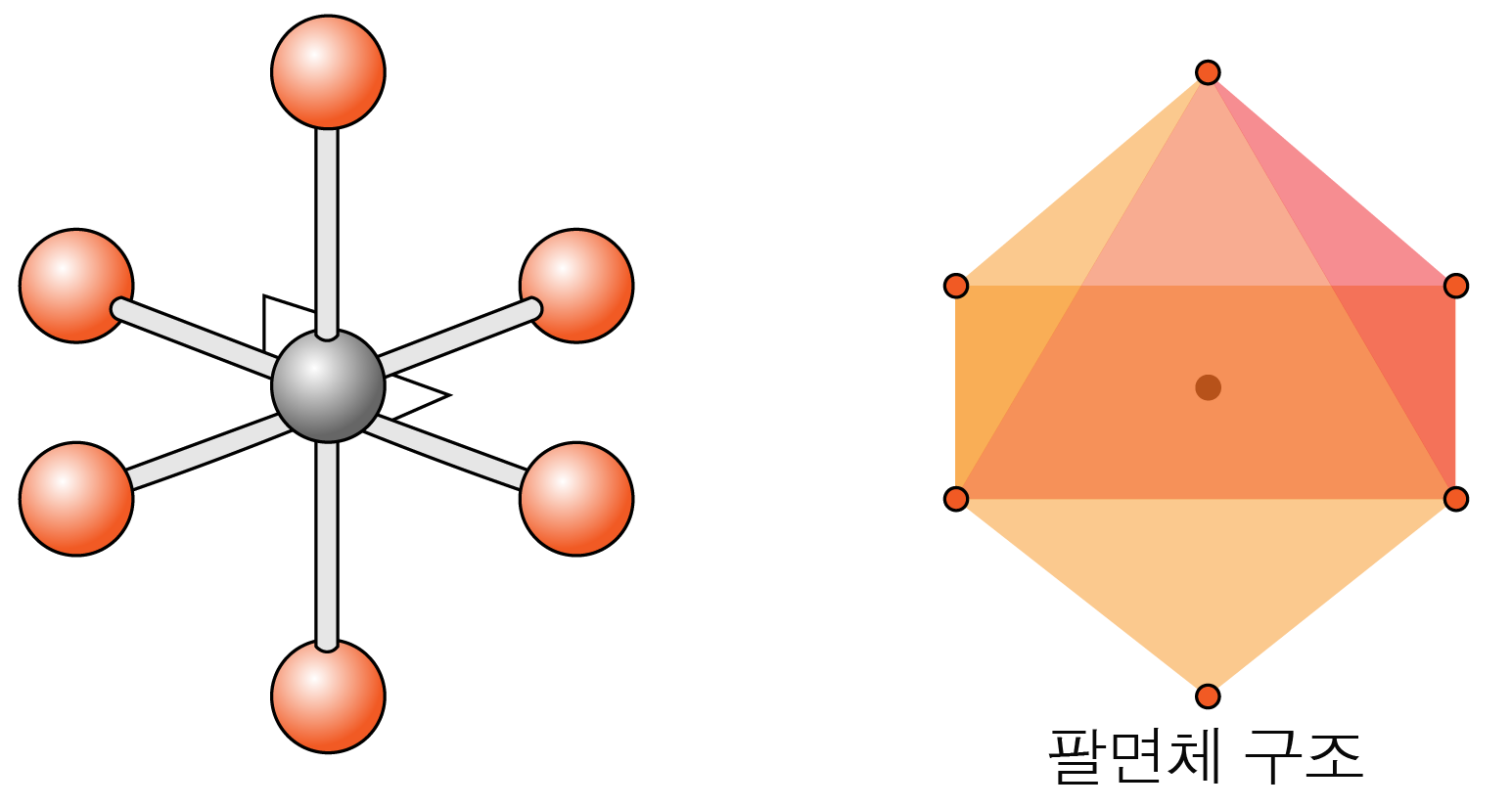
- 결합수가 개, 비공유 전자쌍이 개일 때:
수평면에서 결합각은 약 이고, 수평면과 수직 방향의 결합각은 약 이다.
사각뿔 구조이다.
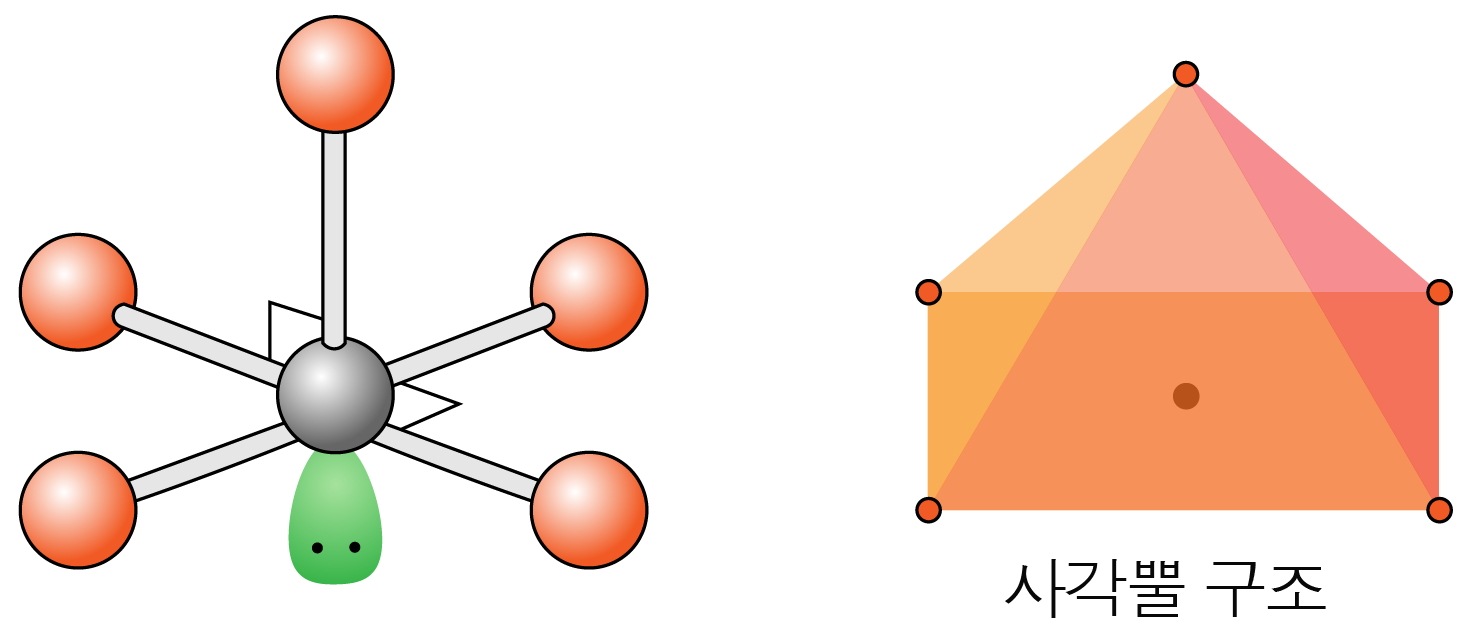
- 결합수가 개, 비공유 전자쌍이 개일 때:
결합각은 이고, 평면 사각형 구조이다.
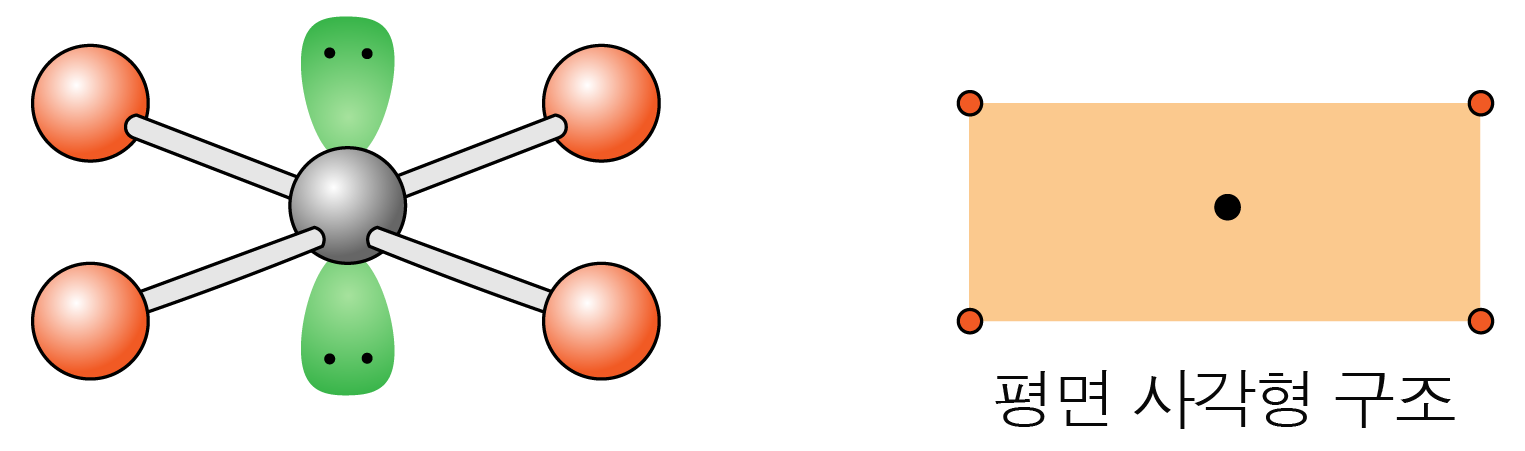
¶ VSEPR 이론 예시
, , , 의 분자 구조를 예측해보자.
의 분자 구조 판단:
는 최외각 전자가 개일 때 안정하고, 개의 최외각 전자를 가지고 있으므로
안정해지기 위해 개의 공유 전자쌍을 형성하려는 경향이 있다.
이를 통해 의 루이스 구조를 그리면 아래 그림과 같다.
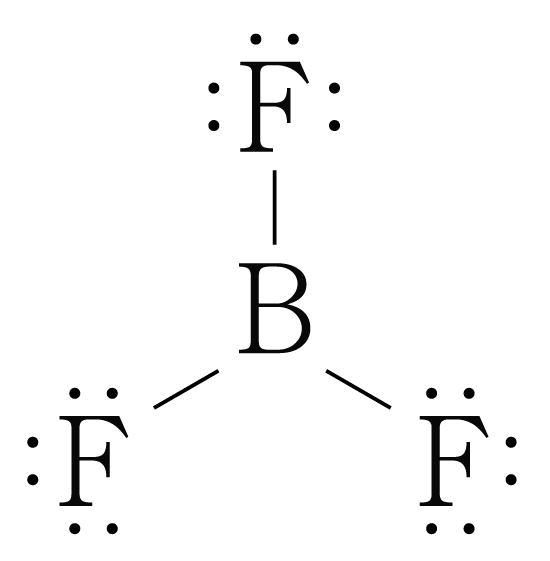
는 개와 결합하고 있으므로 결합수는 개이고, 비공유 전자쌍은 개이다.
따라서 의 결합각은 이고, 평면 삼각형 구조이다.
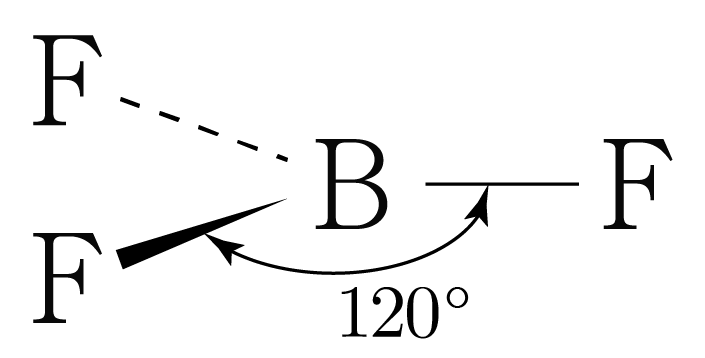
비공유 전자쌍은 생략하였다.
의 분자 구조 판단:
의 루이스 구조를 그리면 아래 그림과 같다.
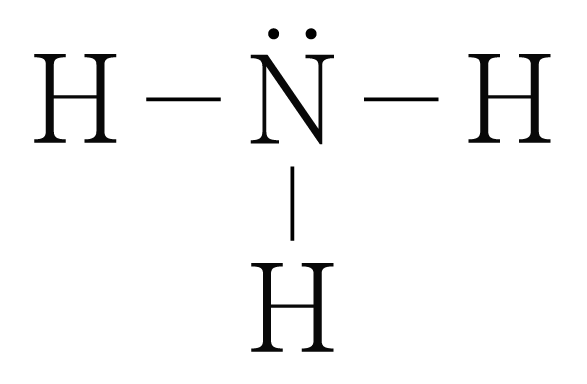
은 개와 결합하고 있으므로 결합수는 개이고, 비공유 전자쌍은 개이다.
따라서 의 결합각은 약 이고, 삼각뿔 구조이다.
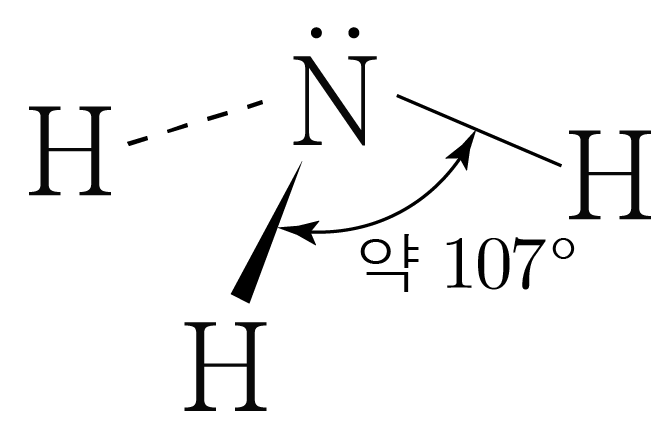
의 분자 구조 판단:
의 루이스 구조를 그리면 아래 그림과 같다.
는 개와 결합하고 있으므로 결합수는 개이고, 비공유 전자쌍은 개이다.
따라서 의 결합각은 이고, 사면체 구조이다.
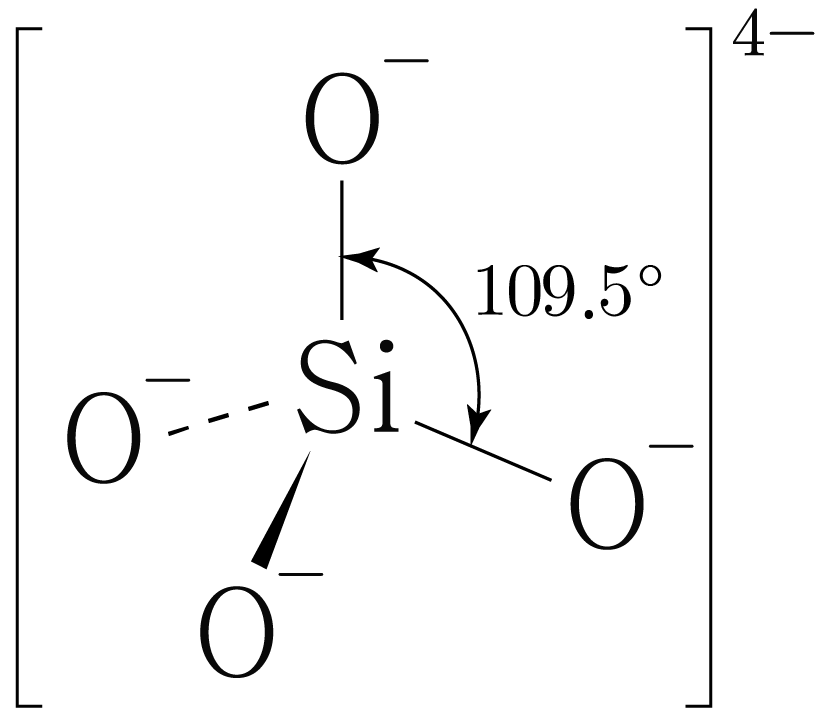
비공유 전자쌍은 생략하였다.
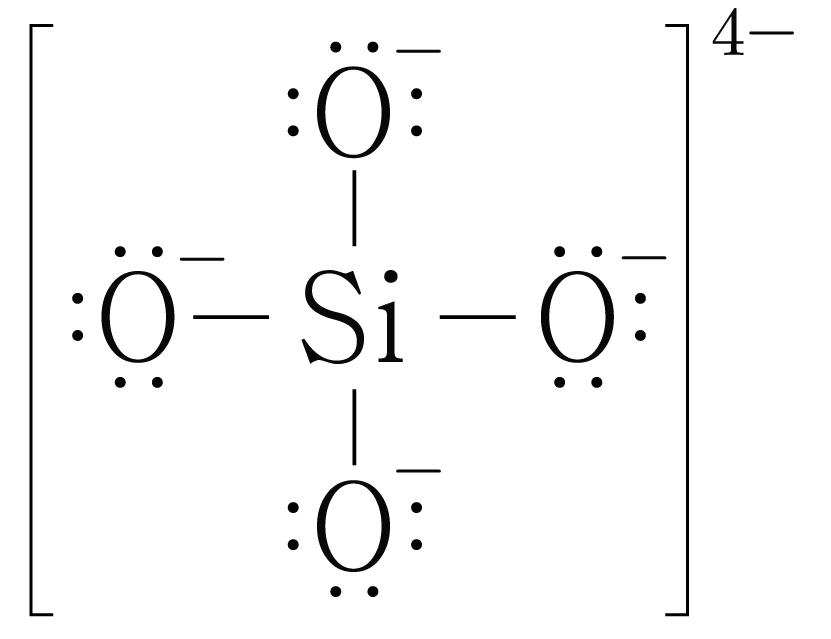
의 분자 구조 판단:
의 루이스 구조를 그리면 아래 그림과 같다.
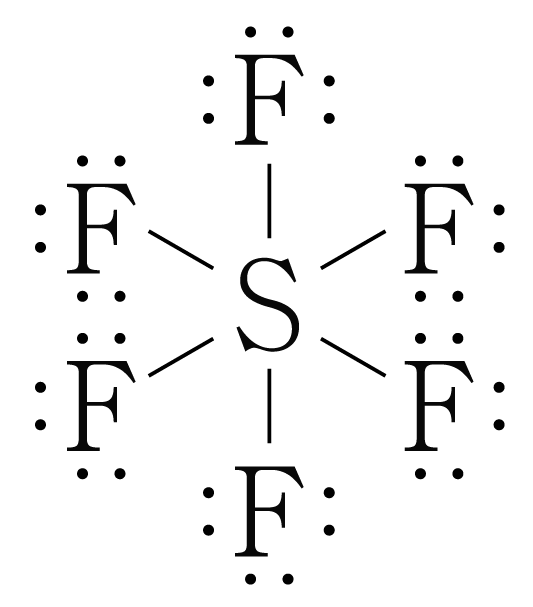
는 개와 결합하고 있으므로 결합수는 개이고, 비공유 전자쌍은 개이다.
따라서 의 수평면에서 결합각은 이고, 수평면과 수직 방향의 결합각은 이며, 팔면체 구조이다.
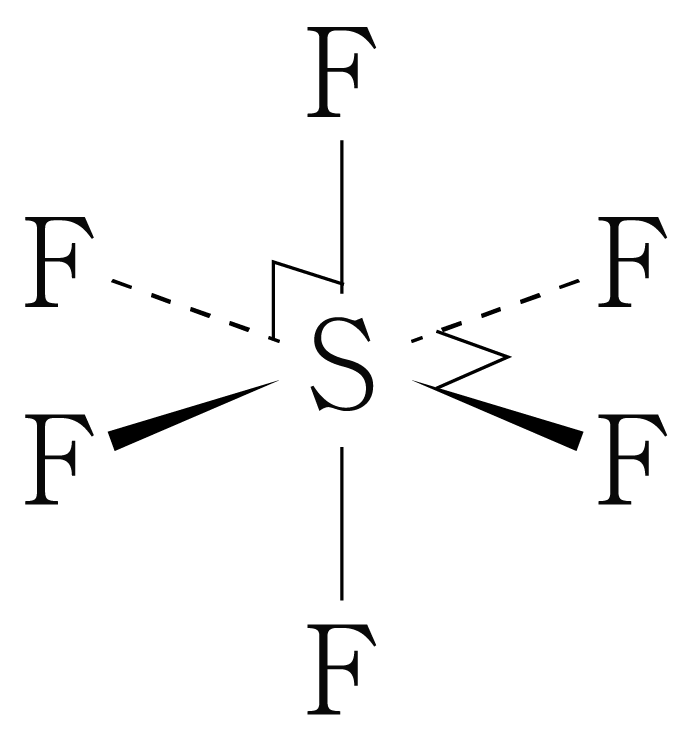
비공유 전자쌍은 생략하였다.
¶ 적용 문항
¶ 1번 문항

정답: $1$
의 분자 구조 판단:
는 최외각 전자가 개일 때 안정하고, 개의 최외각 전자를 가지고 있으므로
안정해지기 위해 개의 공유 전자쌍을 형성하려는 경향이 있다.
이를 통해 의 루이스 구조를 그리면 아래 그림과 같다.
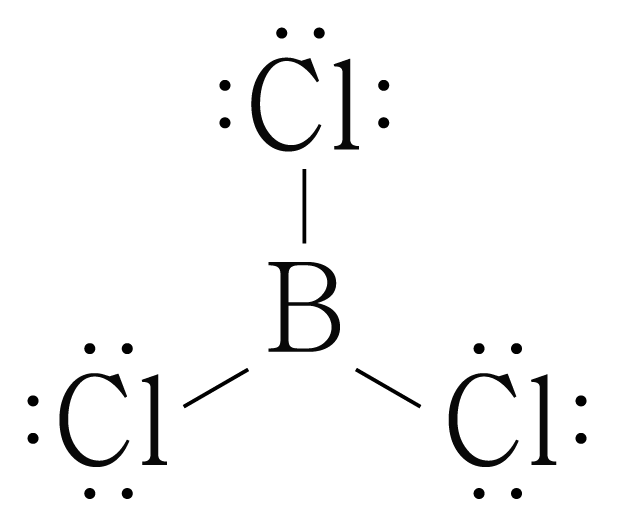
는 개와 결합하고 있으므로 결합수는 개이고, 비공유 전자쌍은 개이다.
따라서 의 결합각은 이고, 평면 삼각형 구조이다.
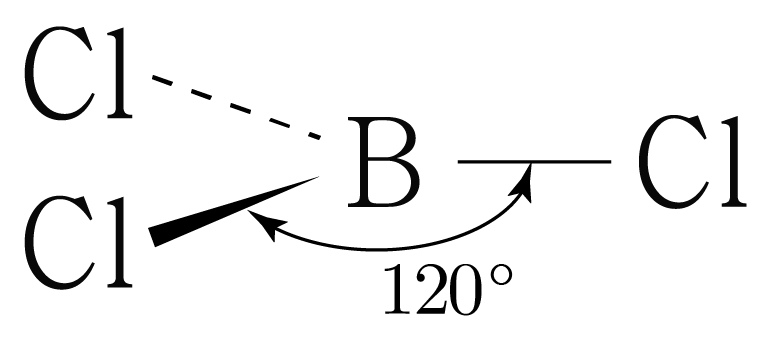
비공유 전자쌍은 생략하였다.
의 분자 구조 판단:
의 루이스 구조를 그리면 아래 그림과 같다.
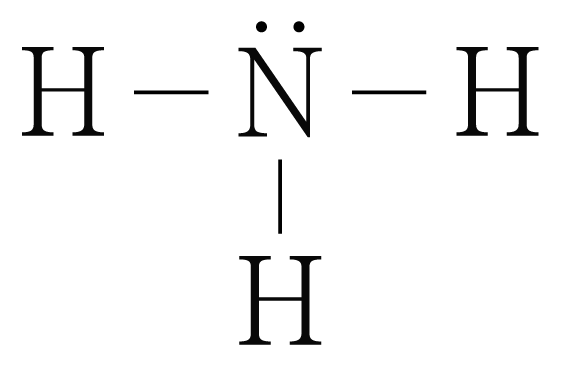
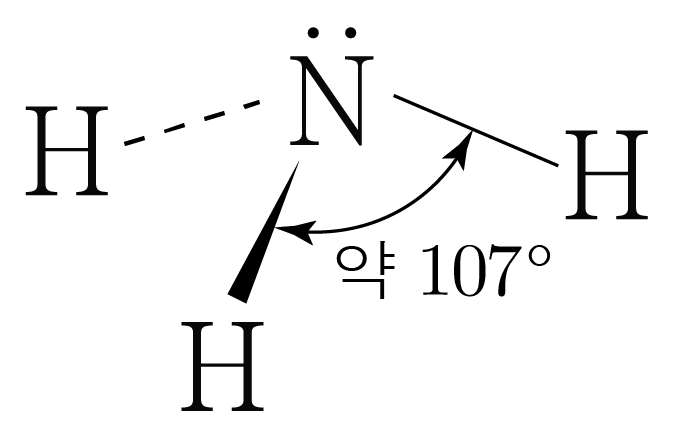
은 개와 결합하고 있으므로 결합수는 개이고, 비공유 전자쌍은 개이다.
따라서 의 결합각은 약 이고, 삼각뿔 구조이다.
ㄱ. 극성 공유 결합은 전기 음성도가 다른 두 원자 사이의 공유 결합이므로 , 모두 극성 공유 결합이 있다. (O)
ㄴ. 의 결합각은 이고, 의 결합각은 약 이다. (X)
ㄷ. 의 분자 모양은 평면 삼각형이고, 의 분자 모양은 삼각뿔이다. (X)
따라서 답은 번이다.
¶ 2번 문항
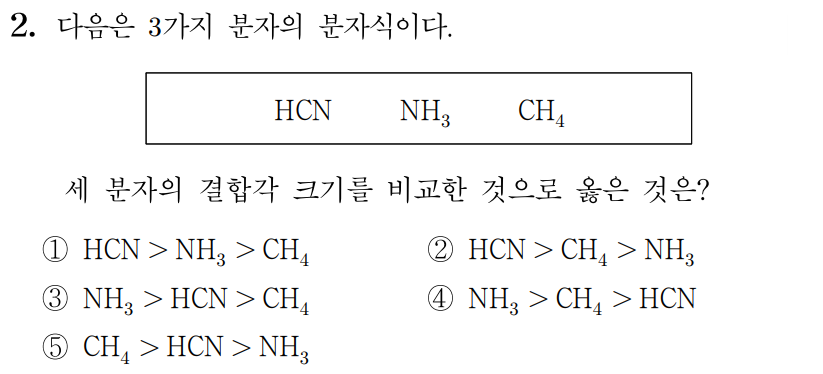
정답: $2$
, , 의 분자 구조를 구해보자.
의 분자 구조 판단:
의 루이스 구조를 그리면 아래 그림과 같다.
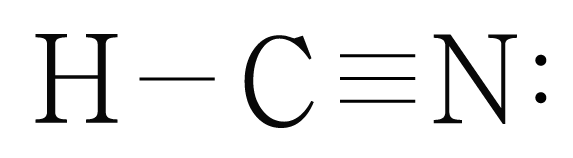
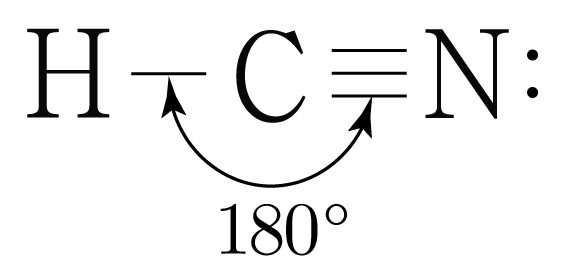
는 개, 개와 결합하고 있으므로 결합수는 개이고, 비공유 전자쌍은 개이다.
따라서 의 결합각은 이고, 선형 구조이다.
의 분자 구조 판단:
의 루이스 구조를 그리면 아래 그림과 같다.
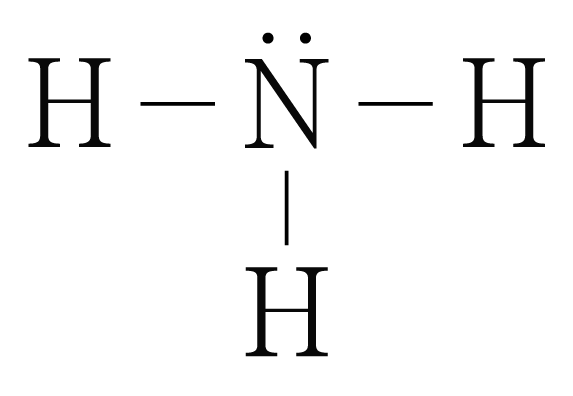
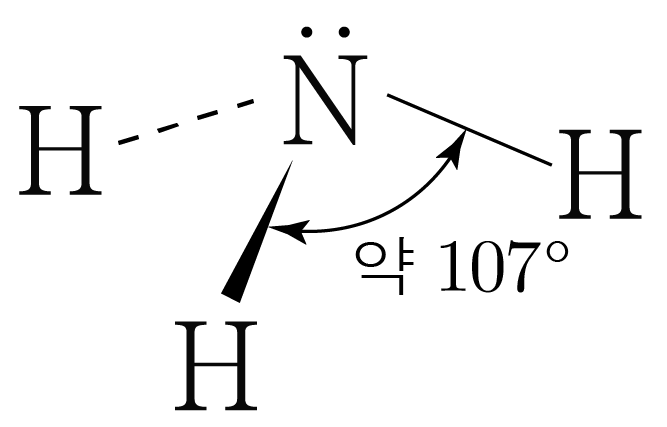
은 개와 결합하고 있으므로 결합수는 개이고, 비공유 전자쌍은 개이다.
따라서 의 결합각은 약 이고, 삼각뿔 구조이다.
의 분자 구조 판단:
의 루이스 구조를 그리면 아래 그림과 같다.
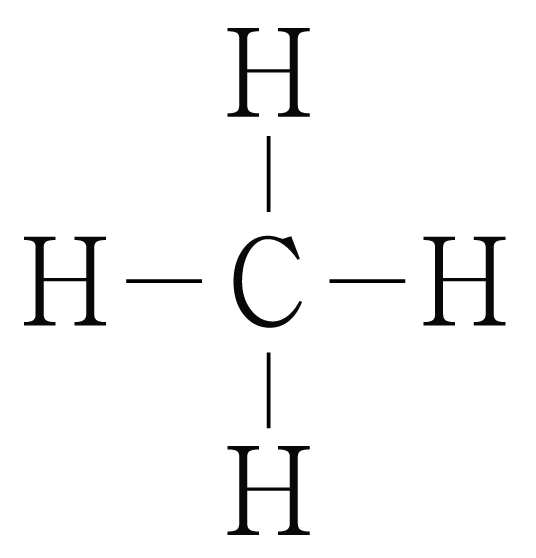
는 개와 결합하고 있으므로 결합수는 개이고, 비공유 전자쌍은 개이다.
따라서 의 결합각은 이고, 사면체 구조이다.
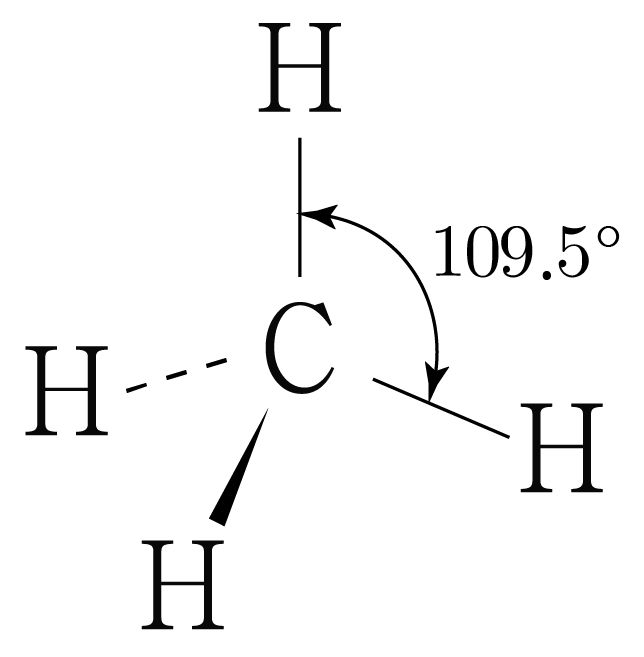
, , 의 결합각은 각각 , 약 , 이므로
세 분자의 결합각 크기를 비교하면 이다.
따라서 답은 번이다.




