¶ 지식 정보
¶ 공명
한 분자를 하나의 루이스 구조로 표현할 수 없을 때, 안정한 여러 구조(공명 구조)로 나타내고,
실제 분자는 이들의 혼합 상태(공명 혼성)로 존재하는 현상이다.
예를 들어, 의 루이스 구조를 그리면 아래 그림과 같이 가지가 가능(두 구조 모두 의 형식 전하는 각각 중 서로 다른 하나로 안정)한데,
실제 결합 길이를 측정해보면 산소 원자간 두 결합의 길이가 서로 같다.

이는 두 구조가 혼합된 상태로 존재(공명)하기 때문이다.
¶ 공명 구조 그리기
공명 구조의 관계에 있는 경우 전자, 결합, 형식 전하의 위치만 바뀔 뿐,
듀엣 규칙이나 옥텟 규칙을 만족하고 원자의 위치는 같다.
공명 구조 관계는 양방향 화살표 를 통해 나타낸다.
전자의 이동을 나타내고자 할 경우, 한방향 화살표를 활용한다.
전자쌍(전자 개)이 이동하는 경우는 로 촉의 날이 양쪽에 있는 화살표를,
전자 개가 이동하는 경우는 로 촉의 날이 한쪽에만 있는 화살표를 활용한다.
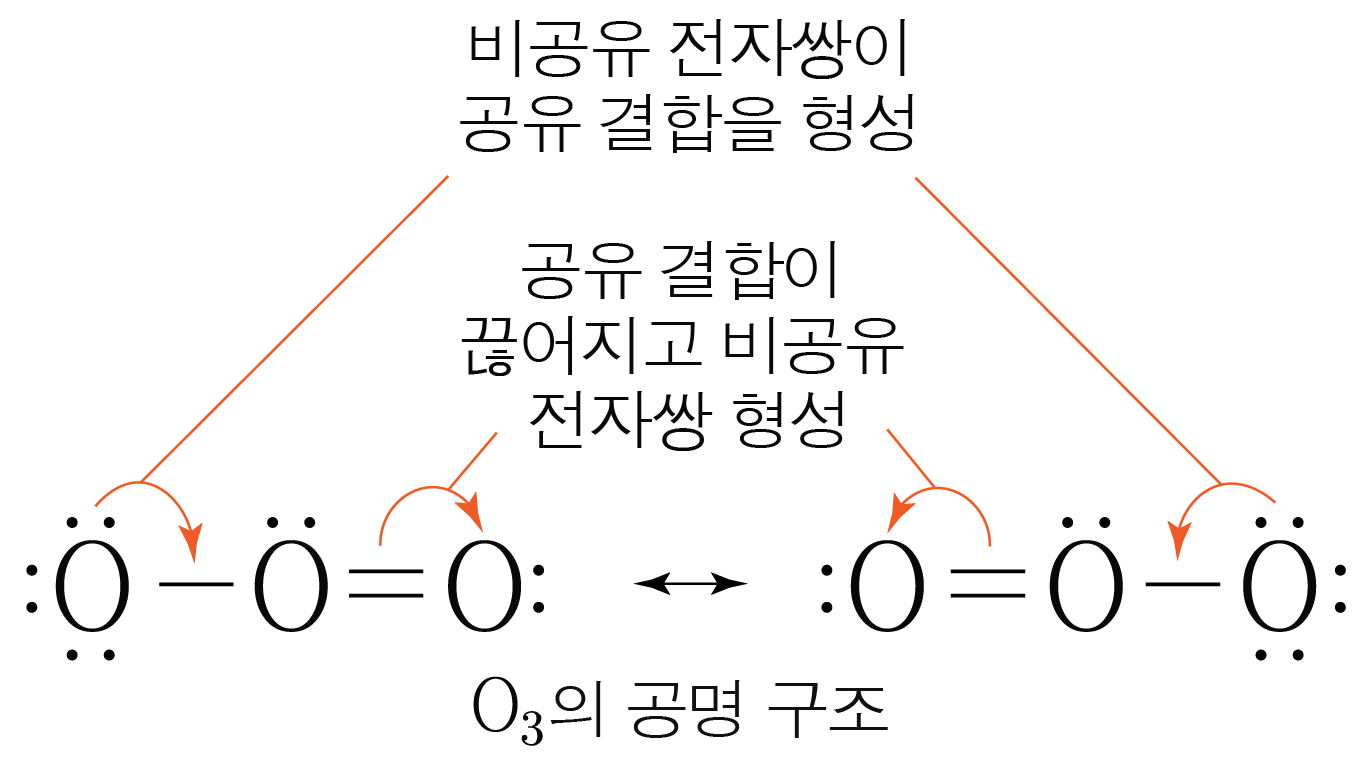
¶ 공명 혼성 그리기
공명 혼성을 그릴 때 비공유 전자 표기는 생략한다.
실제 의 구조는 가지의 공명 구조가 혼합된 공명 혼성을 이루기 때문에
왼쪽 결합과 오른쪽 결합은 단일 결합과 중 결합 사이의 성질을 띤다.
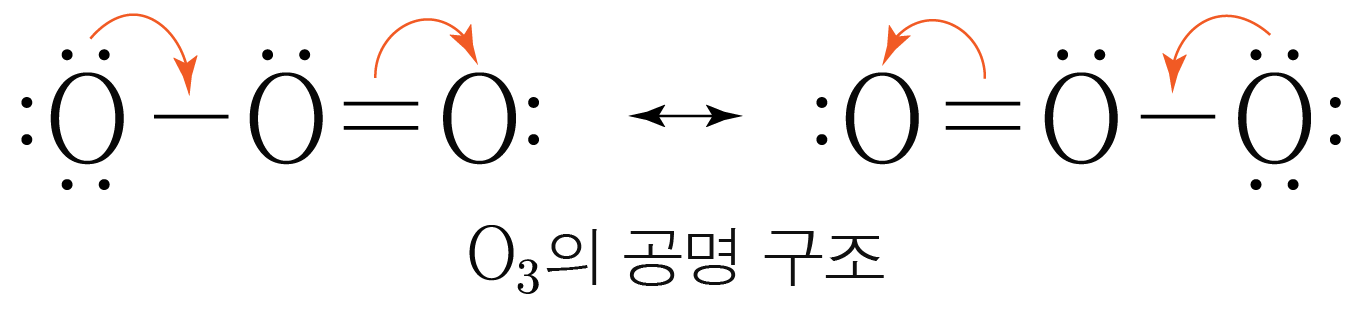
이와 같이 단일 결합과 중 결합 사이의 결합의 경우 아래 그림과 같이 직선과 점선을 통해 공명 혼성을 그린다.

¶ 적용 문항
¶ 1번 문항
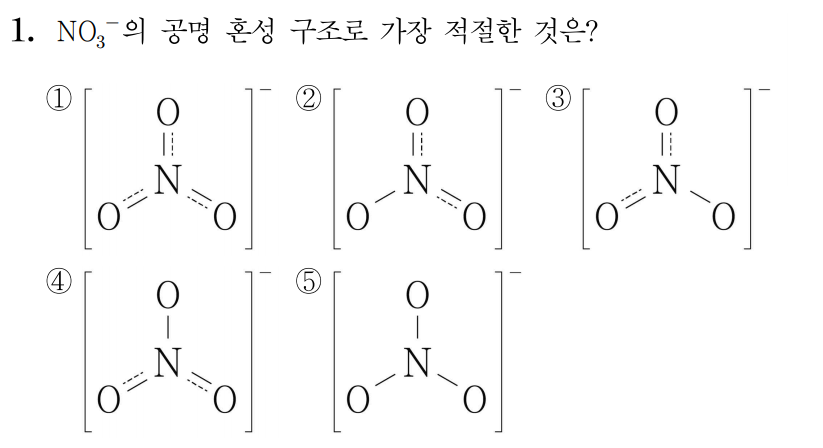
정답: $1$
의 루이스 구조를 그려보자.
화합물을 구성하는 원소들이 자유 원자일 때의 원자가 전자 수(㉠)를 구한다.
는 과 로 이루어지며,
이 자유 원자일 때의 원자가 전자 수는
가 자유 원자일 때의 원자가 전자 수는 이다.
화합물을 구성하는 개별 원자들의 ㉠의 합을 구한다. 화합물이 이온인 경우 ㉠의 합에 얻거나 잃은 전자를 반영해준다.
는 개의 , 개의 로 이루어지므로
화합물을 구성하는 개별 원자들의 ㉠의 합은 이다.
는 전자 개를 추가로 얻어 상대적 전하가 이므로 ㉠의 합에 을 더해 이다.
전기 음성도가 상대적으로 낮은 원자를 중심 원자로 정하고 중심 원자와 나머지 원자 사이에 단일 결합을 그린다.
같은 주기에서 원자 번호가 증가할 때 전기 음성도가 증가하므로 전기 음성도는 이 보다 작다.
따라서 아래 그림과 같이 중심 원자를 으로 정하고, 과 나머지 원자 사이에 단일 결합을 그린다.
남은 전자를 구한 후 바깥쪽 원자에 넣는다.
총 개의 전자에서 개의 전자(개의 단일 결합)가 공유 결합으로 사용되었으므로
남은 전자는 개이다.
남은 전자 개를 바깥쪽 원자에 각각 개씩 넣으면 아래 그림과 같다.
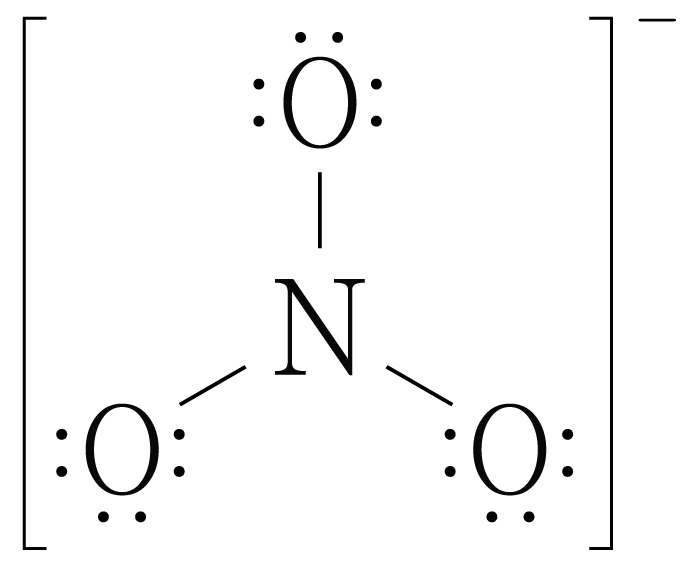
바깥쪽 원자에 넣고도 남은 전자는 중심 원자에 넣고 중심 원자가 옥텟 규칙을 만족하지 않는 경우 다중 결합을 만든다.
남은 전자는 없지만, 중심 원자()가 옥텟 규칙을 만족하지 않으므로
바깥쪽 원자()의 비공유 전자쌍을 공유 전자쌍으로 바꿔 다중 결합(중 결합)을 만들면,
아래 그림과 같이 총 가지의 경우를 만들 수 있다.
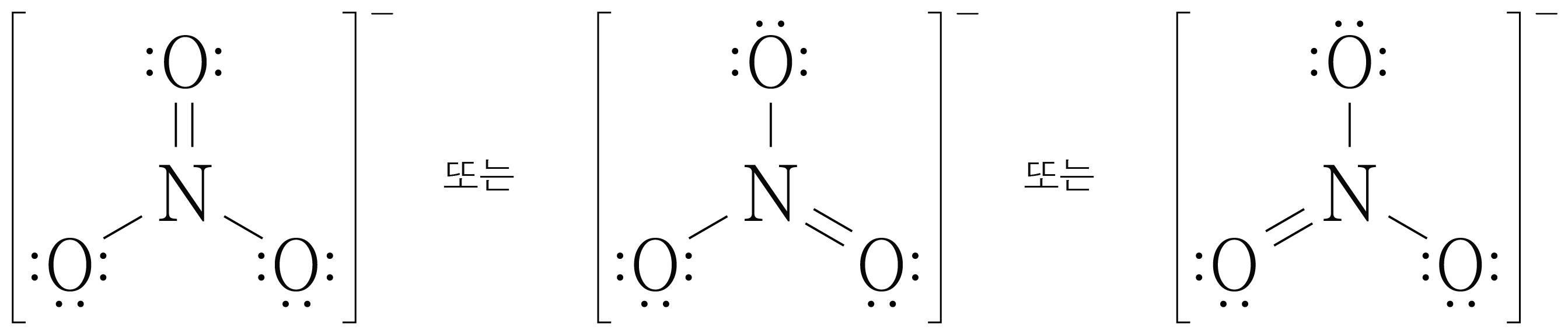
에서 가능한 경우가 여러 개인 경우 각 원자의 형식 전하를 계산하여 형식 전하가 에 가장 가까운 경우(가장 안정한 구조)를 찾는다.
가지의 경우 모두 의 형식 전하는 의 형식 전하는 이 개, 이 개이므로 가장 안정한 구조에 해당한다.
그러므로 공명 구조와 공명 혼성을 그리면 아래 그림과 같다.
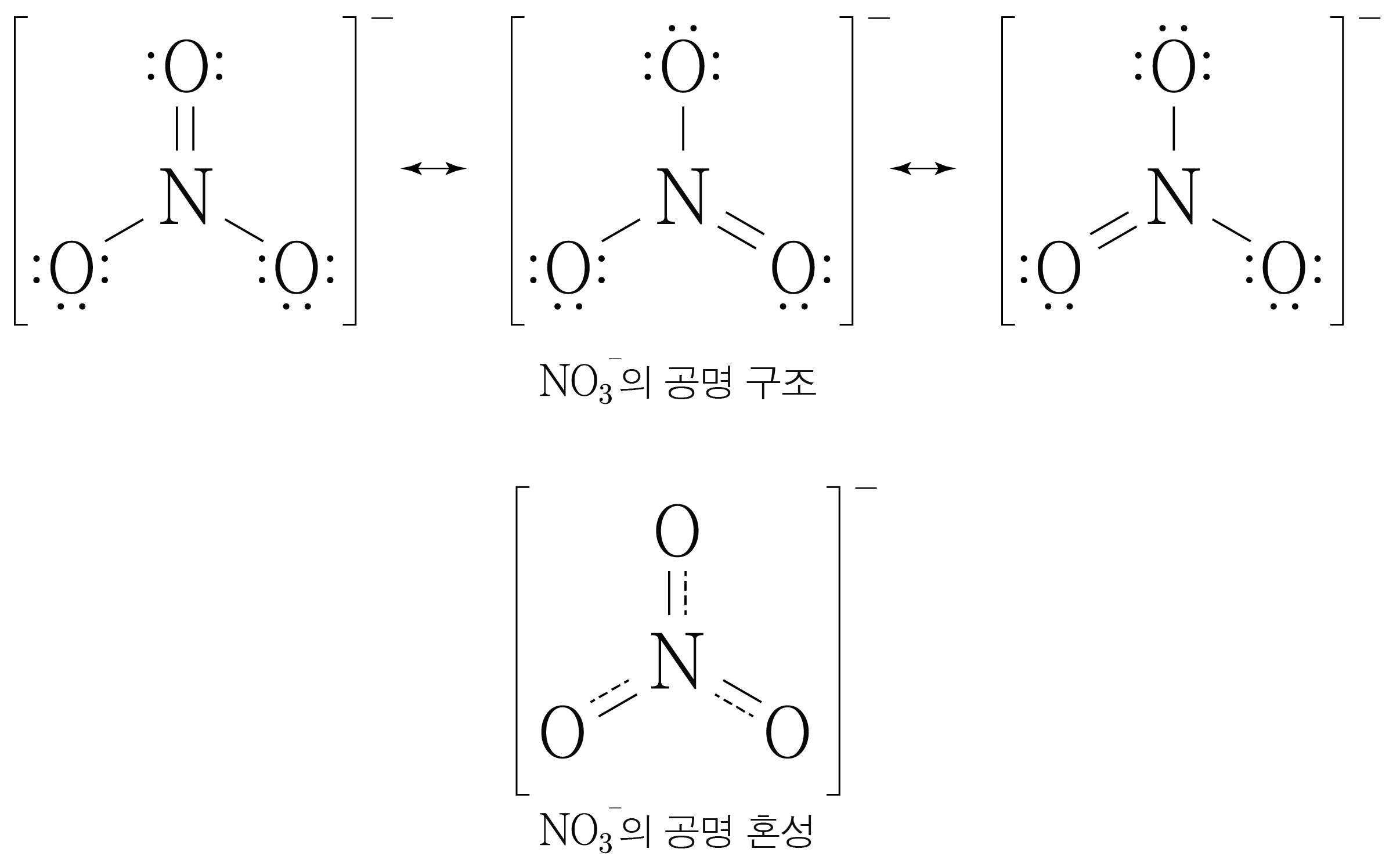
따라서 답은 번이다.
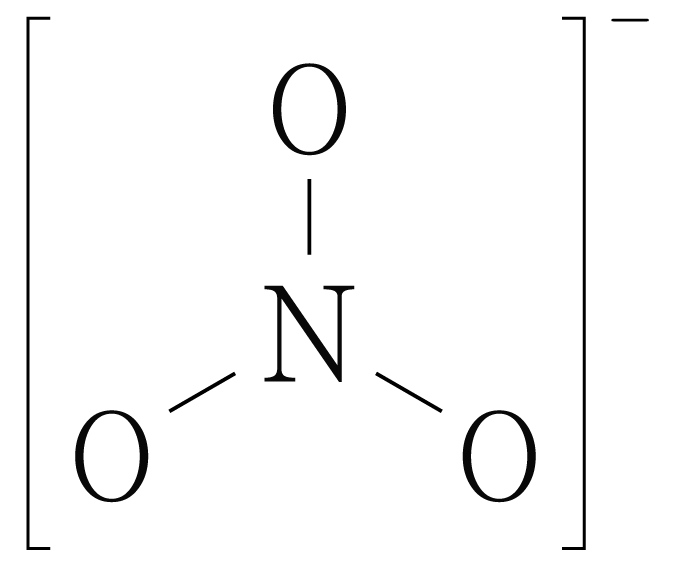
¶ 2번 문항
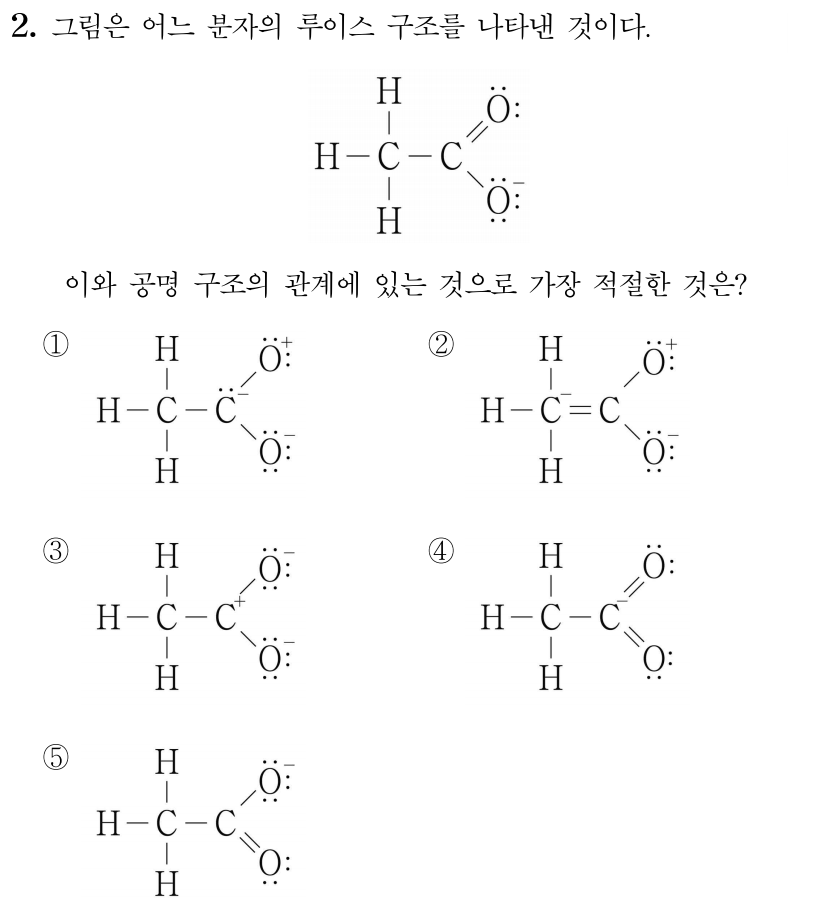
정답: $5$
공명 구조의 관계에 있는 경우 전자, 결합, 형식 전하의 위치만 바뀔 뿐, 듀엣 규칙이나 옥텟 규칙을 만족하고 원자의 위치는 같다.
번은 오른쪽 위 가 옥텟 규칙을 만족하지 않으므로 공명 구조 관계가 아니다.
번은 왼쪽 와 오른쪽 위 가 옥텟 규칙을 만족하지 않으므로 공명 구조 관계가 아니다.
번은 오른쪽 가 옥텟 규칙을 만족하지 않으므로 공명 구조 관계가 아니다.
번은 오른쪽 가 옥텟 규칙을 만족하지 않으므로 공명 구조 관계가 아니다.
번은 전자, 결합, 형식 전하의 위치만 바뀔 뿐 와 가 모두 옥텟 규칙을 만족하므로 공명 구조 관계이다.
따라서 답은 번이다.


