¶ 지식 정보
¶ 흑연
종이를 여러 장 겹쳐 놓은 것과 같이 원자가 층상 구조로 배열된 물질이다.
주로 샤프심이나 연필심의 재료로 사용된다.
¶ 생성 엔탈피
어떤 물질 이 물질을 이루는 원소의 가장 안정한 상태로부터 생성될 때의 반응 엔탈피이다.
단위는 주로 을 사용한다.
원소별 가장 안정한 상태 예시:
- :
- : 흑연
- :
- :
- :
¶ 생성 엔탈피 예시
다음은 에서 와 의 반응의 열화학 반응식이다. 의 표준 생성 엔탈피를 구해보자.
생성 엔탈피는 어떤 물질 이 물질을 이루는 원소의 가장 안정한 상태로부터 생성될 때의 반응 엔탈피이다.
를 이루는 원소는 와 이며, 와 의 가장 안정한 상태는 각각 , 이다.
주어진 열화학 반응식은 를 이루는 원소의 가장 안정한 상태로부터 이 생성될 때 임을 나타내므로
이 생성될 때 엔탈피 변화량은 이다.
따라서 의 표준 생성 엔탈피는 이다.
¶ 결합 해리 에너지
기체 상태의 물질 에서 두 원자 사이의 공유 결합을 끊어 기체 상태의 원자로 만드는 데 필요한 에너지이다.
기호로는 로 나타내며, 단위는 주로 을 사용한다.
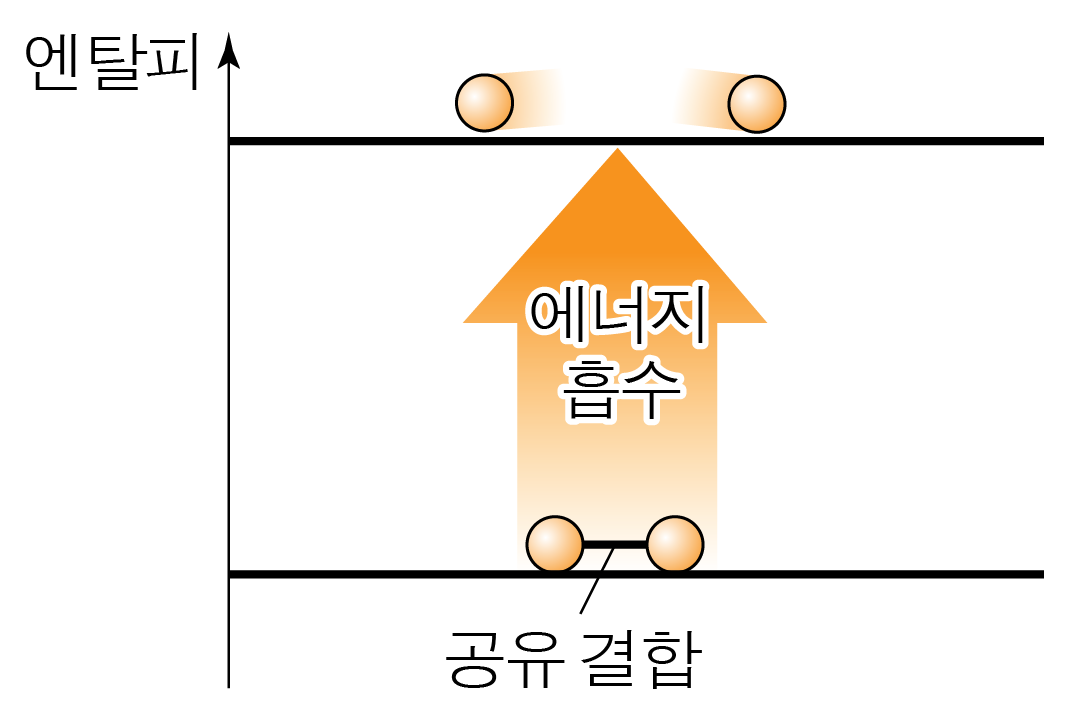
결합 해리 에너지는 동일한 결합 차수, 동일한 원자 사이의 결합이더라도,
해당 결합 주위의 결합 구조가 다르면 화합물마다 약간의 차이가 있을 수 있다.
¶ 결합을 간단히 나타내는 방법
임의의 두 원자 와 사이의 단일 결합, 이중 결합, 삼중 결합은 각각 , , 로 간단히 나타낼 수 있다.
¶ 결합 에너지
동일한 결합 차수, 동일한 원자 사이의 결합들의 결합 해리 에너지를 평균한 값이다.
기호로는 로 나타낸다.
공유 결합의 세기가 클수록 결합을 끊기 어려우므로 결합 에너지는 증가한다.
따라서 결합 에너지는 이다.
¶ 결합 에너지를 통해 반응 엔탈피() 구하기
기체 상태의 화합물의 반응은 반응물의 결합을 끊어 원자 상태가 되고, 이 원자들이 새롭게 결합하여 생성물이 만들어진다고 볼 수 있다.
이때 반응물의 결합을 끊는 과정에서 반응물의 결합 에너지를 흡수하고,
생성물의 결합이 형성되는 과정에서 생성물의 결합 에너지가 방출된다.
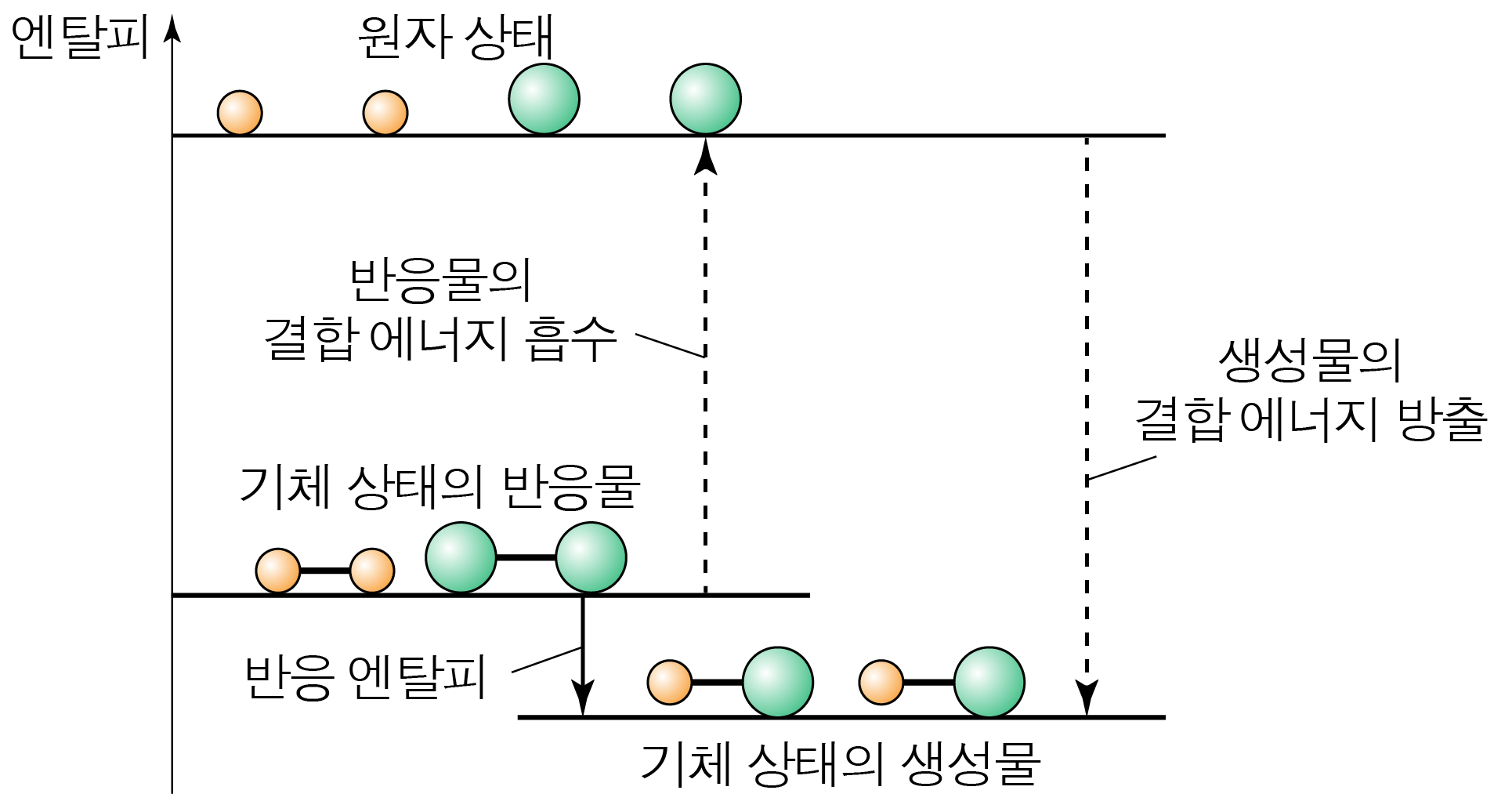
따라서 기체 반응에서 반응 엔탈피는 아래와 같다.
$\Delta H=($반응물의 결합 에너지 총합$)-($생성물의 결합 에너지 총합$)$
¶ 결합 에너지를 통해 반응 엔탈피() 구하기 예시
다음은 에서 와 의 반응의 열화학 반응식과 가지 결합의 결합 에너지이다. 자료로부터 구한 는?
| 결합 | $N\equiv N$ | $N=N$ | $N-N$ | $N-H$ | $H-H$ |
|---|---|---|---|---|---|
| 결합 에너지 $(\mathrm{kJ/mol})$ | $945$ | $418$ | $160$ | $391$ | $436$ |
반응물의 결합 에너지 총합 구하기
반응물인 와 의 루이스 구조를 그리면 아래 그림과 같다.

의 결합 에너지는 에 해당하는 이고,
의 결합 에너지는 에 해당하는 이다.
그러므로 반응물의 결합 에너지 총합은 이다.
생성물의 결합 에너지 총합 구하기
생성물인 의 루이스 구조를 그리면 아래 그림과 같다.
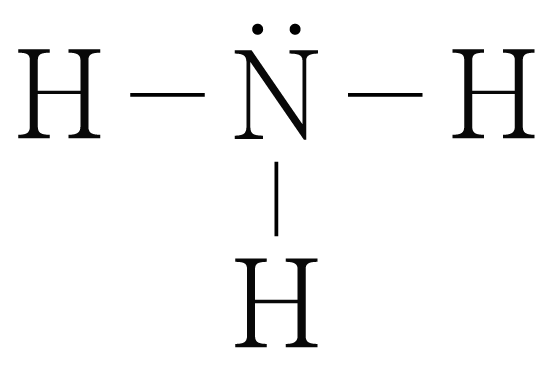
의 결합 에너지는 에 해당하는 이다.
그러므로 생성물의 결합 에너지 총합은 이다.
기체 반응에서 반응 엔탈피 반응물의 결합 에너지 총합생성물의 결합 에너지 총합에서
이다.
¶ 적용 문항
¶ 1번 문항
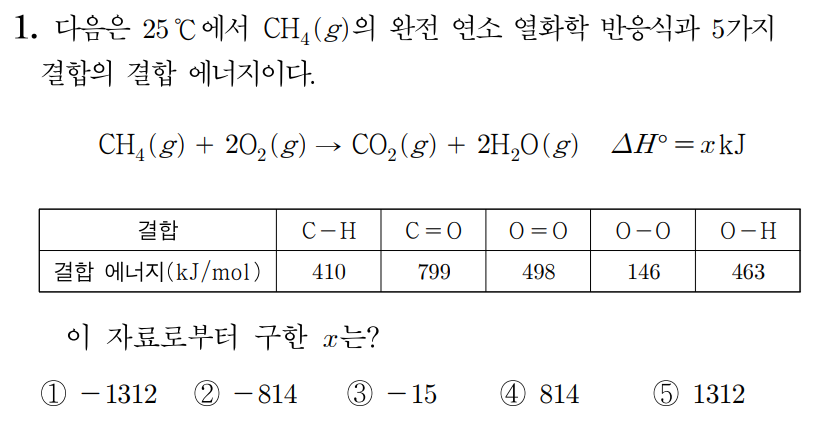
정답: $2$
반응물의 결합 에너지 총합 구하기
반응물인 와 의 루이스 구조를 그리면 아래 그림과 같다.
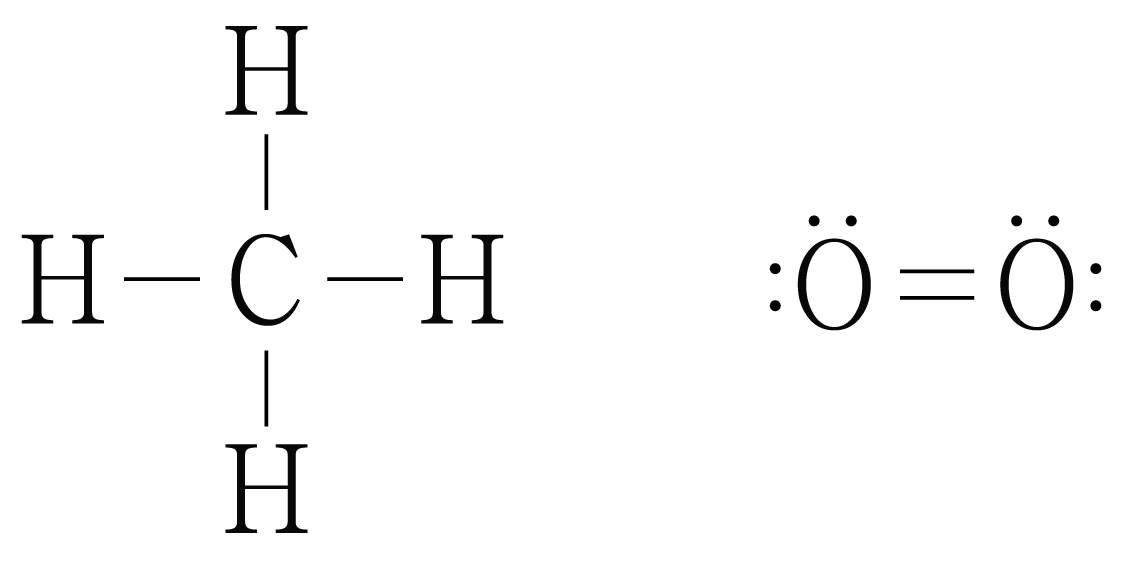
의 결합 에너지는 에 해당하는 이고,
의 결합 에너지는 에 해당하는 이다.
그러므로 반응물의 결합 에너지 총합은 이다.
생성물의 결합 에너지 총합 구하기
생성물인 와 의 루이스 구조를 그리면 아래 그림과 같다.

의 결합 에너지는 에 해당하는 이고,
의 결합 에너지는 에 해당하는 이다.
그러므로 생성물의 결합 에너지 총합은 이다.
기체 반응에서 반응 엔탈피 반응물의 결합 에너지 총합생성물의 결합 에너지 총합에서
이다.
따라서 답은 번이다.
¶ 2번 문항
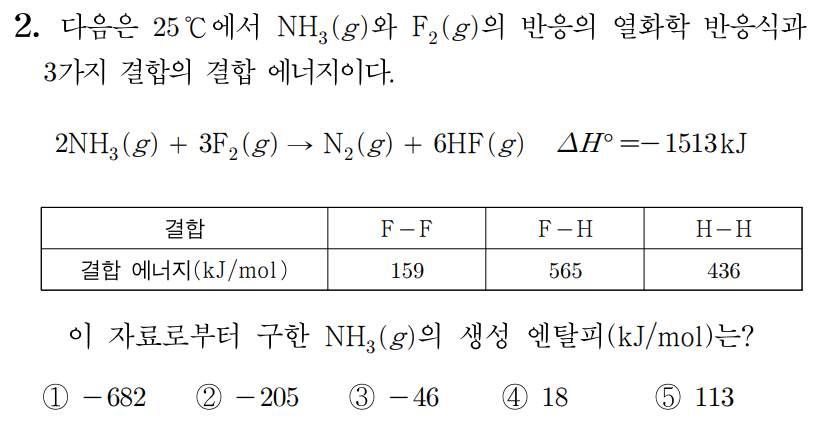
정답: $3$
반응물의 결합 에너지 총합 구하기
반응물인 와 의 루이스 구조를 그리면 아래 그림과 같다.
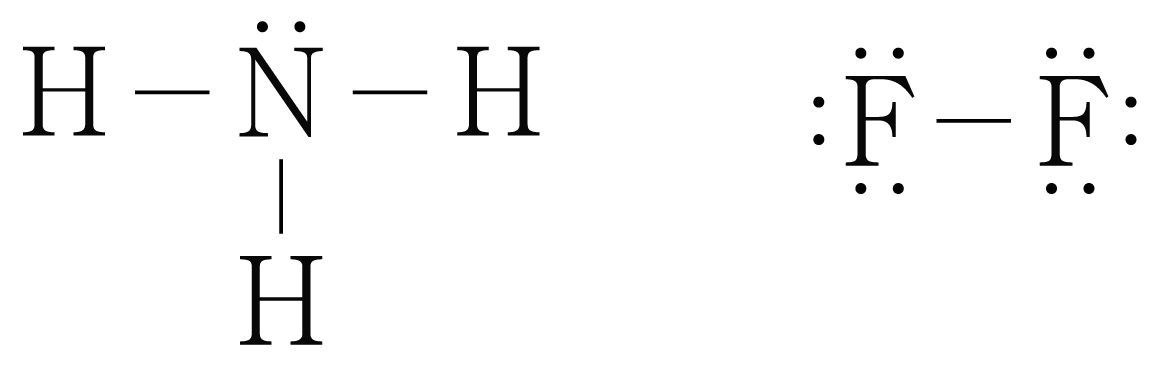
의 결합 에너지를 라 할 때,
의 결합 에너지는 에 해당하는 이고,
의 결합 에너지는 에 해당하는 이다.
그러므로 반응물의 결합 에너지 총합은 이다.
생성물의 결합 에너지 총합 구하기
생성물인 와 의 루이스 구조를 그리면 아래 그림과 같다.

의 결합 에너지를 라 할 때,
의 결합 에너지는 에 해당하는 이고,
의 결합 에너지는 에 해당하는 이다.
그러므로 생성물의 결합 에너지 총합은 이다.
기체 반응에서 반응 엔탈피 반응물의 결합 에너지 총합생성물의 결합 에너지 총합에서
이다.
⋯①이다.
생성 엔탈피는 어떤 물질 이 물질을 이루는 원소의 가장 안정한 상태로부터 생성될 때의 반응 엔탈피이다.
과 의 가장 안정한 상태는 각각 이므로 의 생성 엔탈피는 아래 열화학 반응식에서 에 해당한다.
이제 이 반응식에서 반응물과 생성물의 결합 에너지를 통해 를 구해 보자.
반응물의 결합 에너지 총합 구하기
반응물인 와 의 루이스 구조를 그리면 아래 그림과 같다.

의 결합 에너지는 에 해당하는 이고,
의 결합 에너지는 에 해당하는 이다.
그러므로 반응물의 결합 에너지 총합은 이다.
생성물의 결합 에너지 총합 구하기
생성물인 의 루이스 구조를 그리면 아래 그림과 같다.
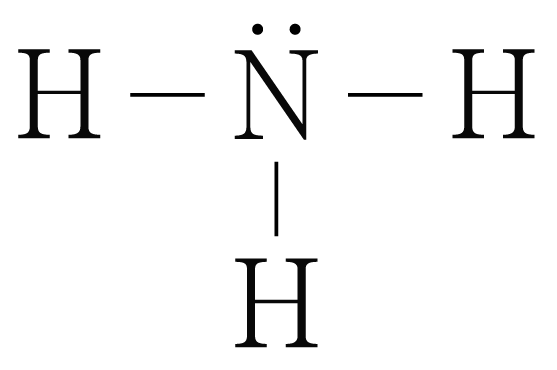
의 결합 에너지는 에 해당하는 이다.
그러므로 생성물의 결합 에너지 총합은 이다.
기체 반응에서 반응 엔탈피 반응물의 결합 에너지 총합생성물의 결합 에너지 총합에서
이다.
이를 ①에 넣으면
⋯①에서
이다.
그러므로 의 생성 엔탈피는 이다.
따라서 답은 번이다.