해당 지식
하위 지식
상위 지식
$-$
어떤 물질 1 m o l 1 m o l
다음은 25 ∘ C 2 5 ∘ C H 2 O H 2 O H 2 O H 2 O
H 2 O ( s ) → H 2 O ( l ) Δ H ∘ = 6 k J H 2 O ( s ) → H 2 O ( l ) Δ H ∘ = 6 k J
고체 상태의 H 2 O H 2 O 1 m o l 1 m o l Δ H ∘ Δ H ∘ 6 k J 6 k J H 2 O H 2 O 6 k J / m o l 6 k J / m o l
또한 역반응은 아래와 같으므로 H 2 O H 2 O − 6 k J / m o l − 6 k J / m o l
H 2 O ( l ) → H 2 O ( s ) Δ H ∘ = − 6 k J H 2 O ( l ) → H 2 O ( s ) Δ H ∘ = − 6 k J
고체 상태의 이온 결합 물질 1 m o l 1 m o l 기체 상태의 양이온과 음이온 으로 만들 때 흡수 되는 에너지이다.k J / m o l k J / m o l
격자 에너지는 흡수 되는 에너지(흡열 반응, Δ H > 0 Δ H > 0 1 m o l 1 m o l
다음은 25 ∘ C 2 5 ∘ C N a + ( g ) N a + ( g ) F − ( g ) F − ( g ) N a F ( s ) N a F ( s )
N a + ( g ) + F − ( g ) → N a F ( s ) Δ H ∘ = − 923 k J N a + ( g ) + F − ( g ) → N a F ( s ) Δ H ∘ = − 9 2 3 k J
표준 상태에서 기체 상태의 양이온인 N a + ( g ) N a + ( g ) F − ( g ) F − ( g ) N a F ( s ) N a F ( s ) 1 m o l 1 m o l 923 k J 9 2 3 k J 방출 되므로 표준 상태에서 N a F ( s ) N a F ( s ) 923 k J / m o l 9 2 3 k J / m o l
고체와 기체 상태의 반응물이 반응하여 이온 결합 물질을 생성하는 반응은 반응 엔탈피(Δ H Δ H
보른-하버 순환은 아래와 같은 과정을 거친다.1. 1 . 2. 2 . 3. 3 . 4. 4 .
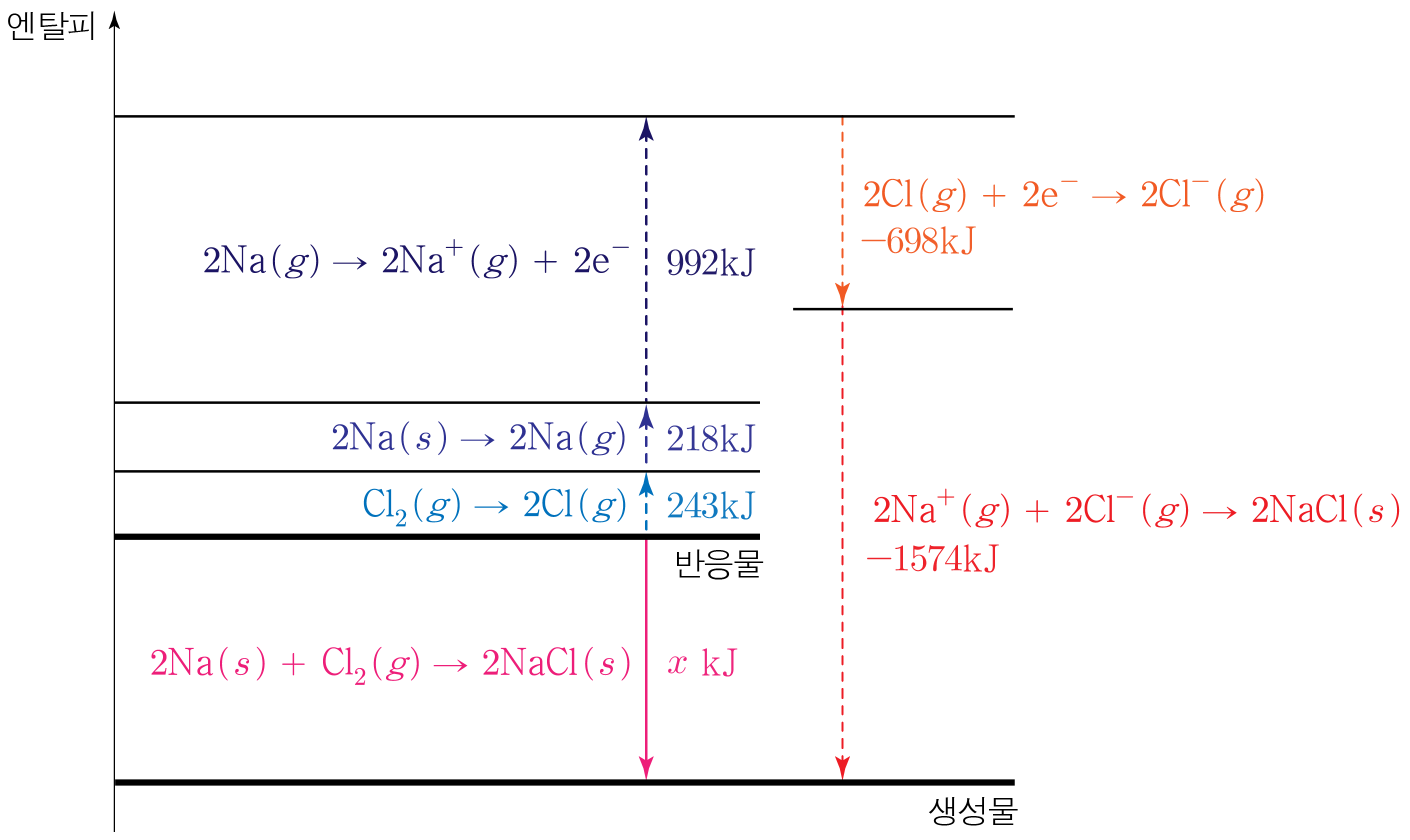
다음은 25 ∘ C 2 5 ∘ C N a ( s ) N a ( s ) C l 2 ( g ) C l 2 ( g ) x x
2 N a ( s ) + C l 2 ( g ) → 2 N a C l ( s ) Δ H ∘ = x k J 2 N a ( s ) + C l 2 ( g ) → 2 N a C l ( s ) Δ H ∘ = x k J
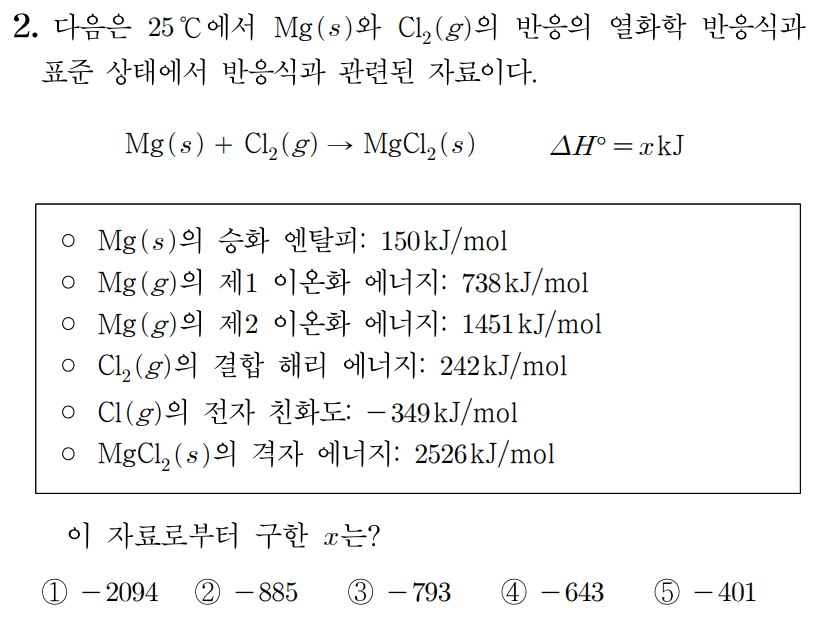
$\circ$ $\mathrm{Na}(s)$의 승화 엔탈피: $109\,\mathrm{kJ/mol}$
1. 1 .
C l 2 ( g ) C l 2 ( g ) 243 k J / m o l 2 4 3 k J / m o l C l 2 ( g ) C l 2 ( g ) 1 m o l 1 m o l C l C l C l ( g ) C l ( g ) 2 m o l 2 m o l 흡수 되는 에너지는243 k J 2 4 3 k J N a ( s ) N a ( s ) 109 k J / m o l 1 0 9 k J / m o l N a ( s ) N a ( s ) 2 m o l 2 m o l N a ( g ) N a ( g ) 2 m o l 2 m o l 흡수 되는 에너지는109 k J / m o l × 2 m o l = 218 k J 1 0 9 k J / m o l × 2 m o l = 2 1 8 k J
2. 2 .
생성물인 N a C l ( s ) N a C l ( s ) N a + N a + N a N a
N a ( g ) N a ( g ) 1 1 496 k J / m o l 4 9 6 k J / m o l N a ( g ) N a ( g ) 2 m o l 2 m o l 2 m o l 2 m o l N a + ( g ) N a + ( g ) 2 m o l 2 m o l 흡수 되는 에너지는496 k J / m o l × 2 m o l = 992 k J 4 9 6 k J / m o l × 2 m o l = 9 9 2 k J
3. 3 .
생성물인 N a C l ( s ) N a C l ( s ) C l − C l − C l C l
C l ( g ) C l ( g ) − 349 k J / m o l − 3 4 9 k J / m o l C l ( g ) C l ( g ) 2 m o l 2 m o l 2 m o l 2 m o l C l − ( g ) C l − ( g ) 2 m o l 2 m o l 방출 되는 에너지는349 k J / m o l × 2 m o l = 698 k J 3 4 9 k J / m o l × 2 m o l = 6 9 8 k J
4. 4 .
N a C l ( s ) N a C l ( s ) 787 k J / m o l 7 8 7 k J / m o l N a + ( g ) N a + ( g ) 2 m o l 2 m o l C l − ( g ) C l − ( g ) 2 m o l 2 m o l N a C l ( s ) N a C l ( s ) 2 m o l 2 m o l 방출 되는 에너지는787 k J / m o l × 2 m o l = 1574 k J 7 8 7 k J / m o l × 2 m o l = 1 5 7 4 k J
따라서 엔탈피 변화 과정을 나타내면 아래 그림과 같다.
그러므로218 k J + 243 k J + 992 k J − 698 k J − 1574 k J = x k J , 2 1 8 k J + 2 4 3 k J + 9 9 2 k J − 6 9 8 k J − 1 5 7 4 k J = x k J , 461 k J + 992 k J − 698 k J − 1574 k J = x k J , 4 6 1 k J + 9 9 2 k J − 6 9 8 k J − 1 5 7 4 k J = x k J , 1453 k J − 698 k J − 1574 k J = x k J , 1 4 5 3 k J − 6 9 8 k J − 1 5 7 4 k J = x k J , 755 k J − 1574 k J = x k J , 7 5 5 k J − 1 5 7 4 k J = x k J , − 819 k J = x k J , − 8 1 9 k J = x k J , x = − 819 x = − 8 1 9
1번 문항 정답 및 해설 보기
정답: $3$
1. 1 .
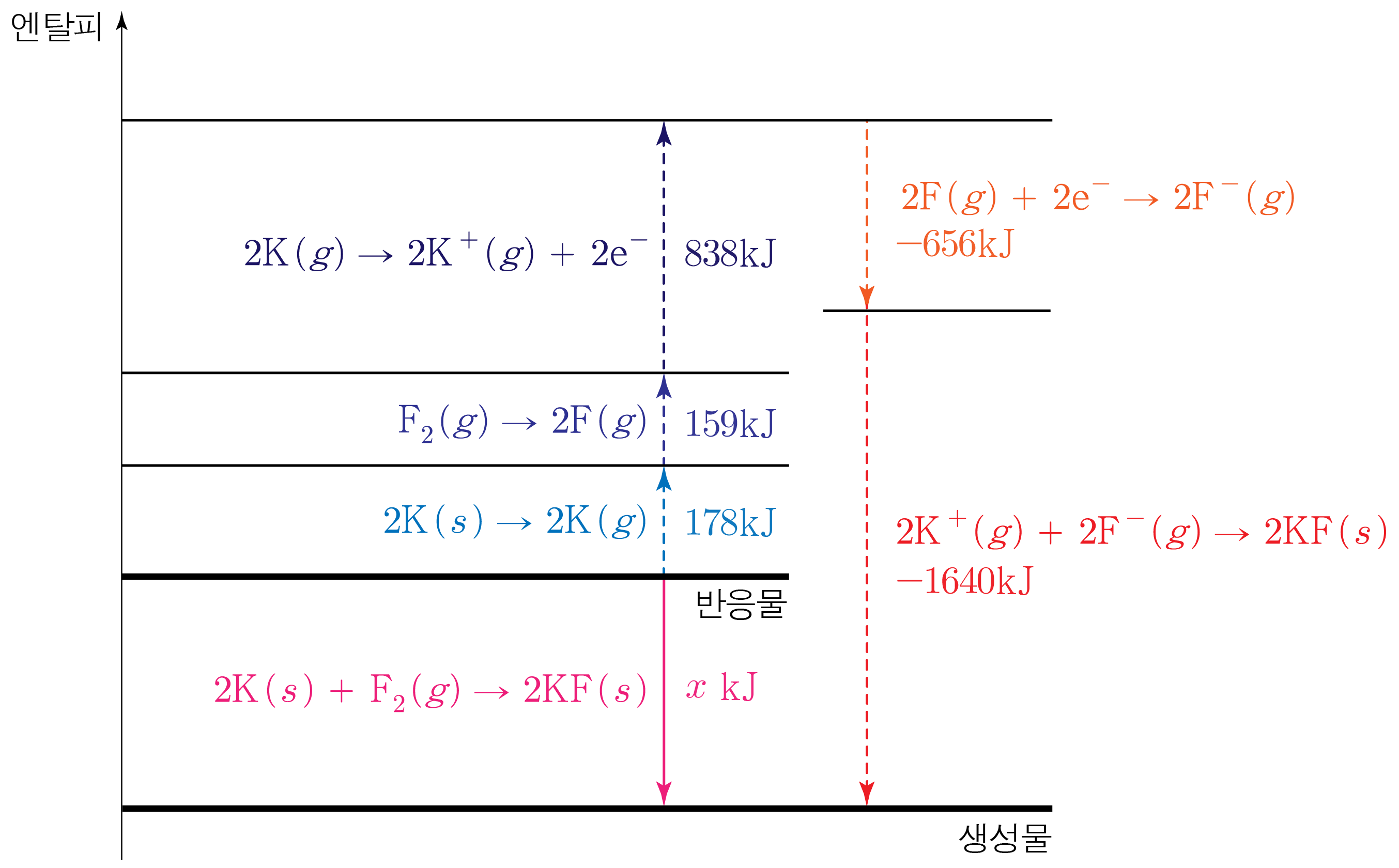
F 2 ( g ) F 2 ( g ) 159 k J / m o l 1 5 9 k J / m o l F 2 ( g ) F 2 ( g ) 1 m o l 1 m o l F F F ( g ) F ( g ) 2 m o l 2 m o l 흡수 되는 에너지는159 k J 1 5 9 k J K ( s ) K ( s ) 89 k J / m o l 8 9 k J / m o l K ( s ) K ( s ) 2 m o l 2 m o l K ( g ) K ( g ) 2 m o l 2 m o l 흡수 되는 에너지는89 k J / m o l × 2 m o l = 178 k J 8 9 k J / m o l × 2 m o l = 1 7 8 k J
2. 2 .
생성물인 K F ( s ) K F ( s ) K + K + K K
K ( g ) K ( g ) 1 1 419 k J / m o l 4 1 9 k J / m o l K ( g ) K ( g ) 2 m o l 2 m o l 2 m o l 2 m o l K + ( g ) K + ( g ) 2 m o l 2 m o l 흡수 되는 에너지는 419 k J / m o l × 2 m o l = 838 k J 4 1 9 k J / m o l × 2 m o l = 8 3 8 k J
3. 3 .
생성물인 K F ( s ) K F ( s ) F − F − F F
F ( g ) F ( g ) − 328 k J / m o l − 3 2 8 k J / m o l F ( g ) F ( g ) 2 m o l 2 m o l 2 m o l 2 m o l F − ( g ) F − ( g ) 2 m o l 2 m o l 방출 되는 에너지는328 k J / m o l × 2 m o l = 656 k J 3 2 8 k J / m o l × 2 m o l = 6 5 6 k J
4. 4 .
K F ( s ) K F ( s ) 820 k J / m o l 8 2 0 k J / m o l K + ( g ) K + ( g ) 2 m o l 2 m o l F − ( g ) F − ( g ) 2 m o l 2 m o l K F ( s ) K F ( s ) 2 m o l 2 m o l 방출 되는 에너지는820 k J / m o l × 2 m o l = 1640 k J 8 2 0 k J / m o l × 2 m o l = 1 6 4 0 k J
따라서 엔탈피 변화 과정을 나타내면 아래 그림과 같다.
그러므로178 k J + 159 k J + 838 k J − 656 k J − 1640 k J = x k J , 1 7 8 k J + 1 5 9 k J + 8 3 8 k J − 6 5 6 k J − 1 6 4 0 k J = x k J , 337 k J + 838 k J − 656 k J − 1640 k J = x k J , 3 3 7 k J + 8 3 8 k J − 6 5 6 k J − 1 6 4 0 k J = x k J , 1175 k J − 656 k J − 1640 k J = x k J , 1 1 7 5 k J − 6 5 6 k J − 1 6 4 0 k J = x k J , 519 k J − 1640 k J = x k J , 5 1 9 k J − 1 6 4 0 k J = x k J , − 1121 k J = x k J , − 1 1 2 1 k J = x k J , x = − 1121 x = − 1 1 2 1
따라서 답은 3 3
2번 문항 정답 및 해설 보기
정답: $4$
1. 1 .
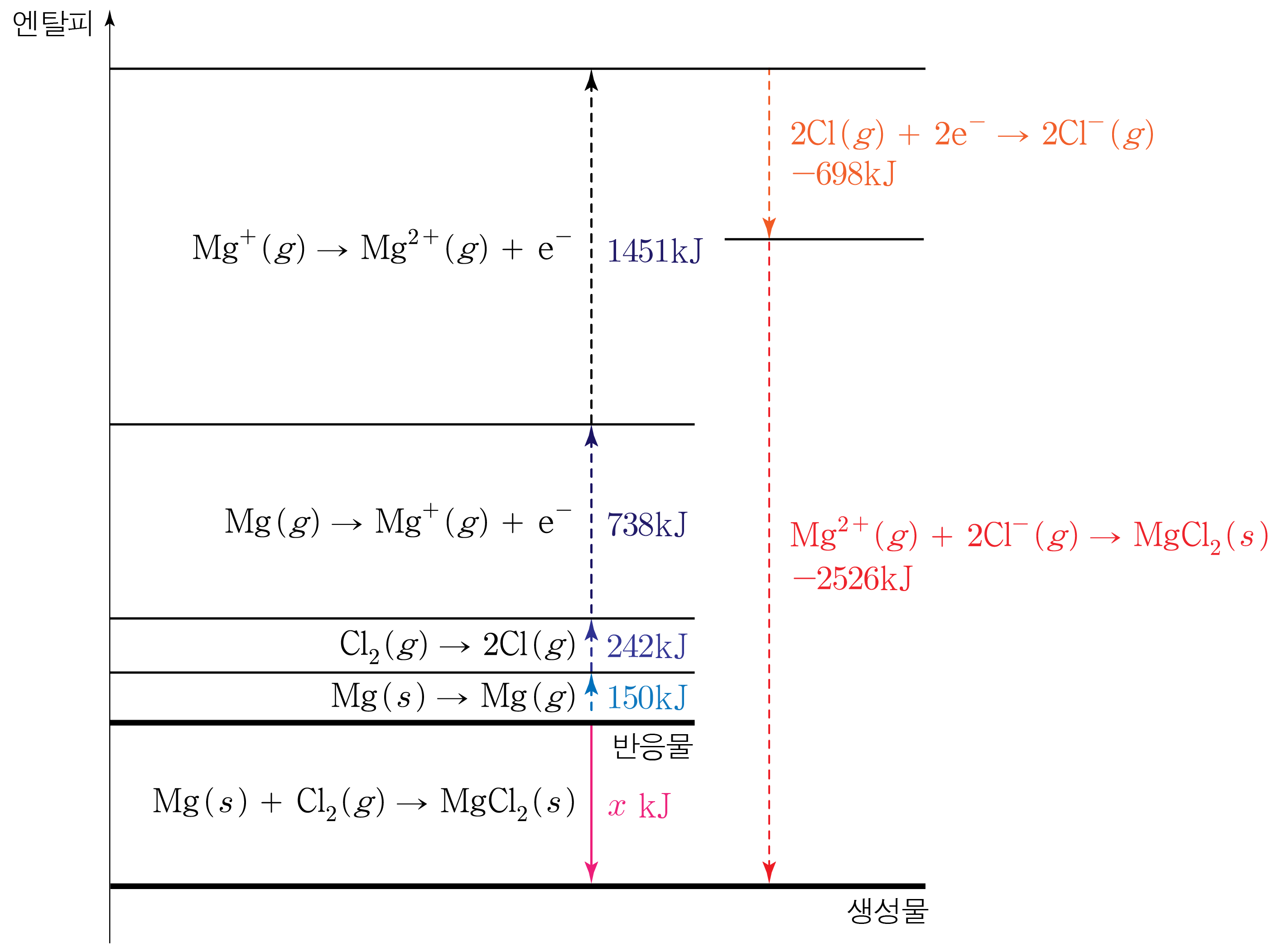
C l 2 ( g ) C l 2 ( g ) 242 k J / m o l 2 4 2 k J / m o l C l 2 ( g ) C l 2 ( g ) 1 m o l 1 m o l C l C l C l ( g ) C l ( g ) 2 m o l 2 m o l 흡수 되는 에너지는242 k J 2 4 2 k J
M g ( s ) M g ( s ) 150 k J / m o l 1 5 0 k J / m o l M g ( s ) M g ( s ) 1 m o l 1 m o l M g ( g ) M g ( g ) 1 m o l 1 m o l 흡수 되는 에너지는150 k J / m o l × 1 m o l = 150 k J 1 5 0 k J / m o l × 1 m o l = 1 5 0 k J
2. 2 .
생성물인 M g C l 2 ( s ) M g C l 2 ( s ) M g 2 + M g 2 + M g M g
M g ( g ) M g ( g ) 1 1 738 k J / m o l 7 3 8 k J / m o l M g ( g ) M g ( g ) 1 m o l 1 m o l 1 m o l 1 m o l M g + ( g ) M g + ( g ) 1 m o l 1 m o l 흡수 되는 에너지는738 k J / m o l × 1 m o l = 738 k J 7 3 8 k J / m o l × 1 m o l = 7 3 8 k J
M g ( g ) M g ( g ) 2 2 1451 k J / m o l 1 4 5 1 k J / m o l M g + ( g ) M g + ( g ) 1 m o l 1 m o l 1 m o l 1 m o l M g 2 + ( g ) M g 2 + ( g ) 1 m o l 1 m o l 흡수 되는 에너지는1451 k J / m o l × 1 m o l = 1451 k J 1 4 5 1 k J / m o l × 1 m o l = 1 4 5 1 k J
3. 3 .
생성물인 M g C l 2 ( s ) M g C l 2 ( s ) C l − C l − C l C l
C l ( g ) C l ( g ) − 349 k J / m o l − 3 4 9 k J / m o l C l ( g ) C l ( g ) 2 m o l 2 m o l 2 m o l 2 m o l C l − ( g ) C l − ( g ) 2 m o l 2 m o l 방출 되는 에너지는349 k J / m o l × 2 m o l = 698 k J 3 4 9 k J / m o l × 2 m o l = 6 9 8 k J
4. 4 .
M g C l 2 ( s ) M g C l 2 ( s ) 2526 k J / m o l 2 5 2 6 k J / m o l M g 2 + ( g ) M g 2 + ( g ) 1 m o l 1 m o l C l − ( g ) C l − ( g ) 2 m o l 2 m o l M g C l 2 ( s ) M g C l 2 ( s ) 1 m o l 1 m o l 방출 되는 에너지는2526 k J / m o l × 1 m o l = 2526 k J 2 5 2 6 k J / m o l × 1 m o l = 2 5 2 6 k J
따라서 엔탈피 변화 과정을 나타내면 아래 그림과 같다.
그러므로 150 k J + 242 k J + 738 k J + 1451 k J − 698 k J − 2526 k J = x k J , 1 5 0 k J + 2 4 2 k J + 7 3 8 k J + 1 4 5 1 k J − 6 9 8 k J − 2 5 2 6 k J = x k J , 392 k J + 738 k J + 1451 k J − 698 k J − 2526 k J = x k J , 3 9 2 k J + 7 3 8 k J + 1 4 5 1 k J − 6 9 8 k J − 2 5 2 6 k J = x k J , 1130 k J + 1451 k J − 698 k J − 2526 k J = x k J , 1 1 3 0 k J + 1 4 5 1 k J − 6 9 8 k J − 2 5 2 6 k J = x k J , 2581 k J − 698 k J − 2526 k J = x k J , 2 5 8 1 k J − 6 9 8 k J − 2 5 2 6 k J = x k J , 1883 k J − 2526 k J = x k J , 1 8 8 3 k J − 2 5 2 6 k J = x k J , − 643 k J = x k J , − 6 4 3 k J = x k J , x = − 643 k J x = − 6 4 3 k J
따라서 답은 4 4