¶ 지식 정보
¶ 순물질과 혼합물
¶ 순물질
하나의 종류로만 이루어진 물질로, 홑원소 물질과 화합물로 나눌 수 있다.
¶ 홑원소 물질
가지 원소로만 구성된 순물질이다.
¶ 화합물
가지 이상의 원소로 구성된 순물질이다. 개의 원소로 구성된 화합물은 성분 화합물이라 한다.
¶ 혼합물
두 종류 이상의 순물질이 섞여 있는 것이다.
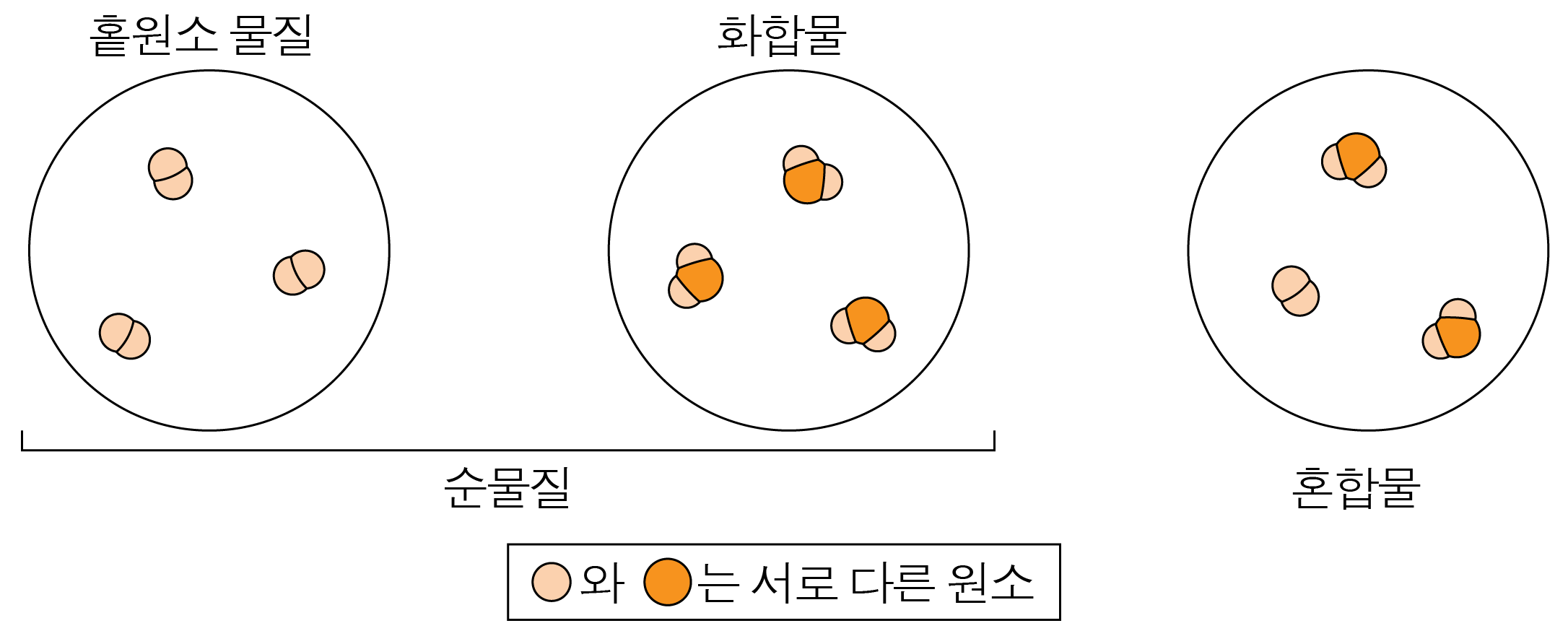
¶ 순물질과 혼합물의 예시
-
순물질-홑원소 물질 예시:
가스통에 있는 순수한 수소 기체, 가스통에 있는 순수한 헬륨 기체 -
순물질-화합물 예시:
염화 나트륨, 가스통에 있는 순수한 이산화 탄소 -
혼합물 예시:
염화 나트륨 수용액, 대기 등
¶ 관용명
오래전부터 흔히 쓰이고 있는 물질의 명칭이다.
¶ 관용명 예시
| 관용명 | 화학식 |
|---|---|
| 수소 | $\mathrm{H_2}$ |
| 산소 | $\mathrm{O_2}$ |
| 오존 | $\mathrm{O_3}$ |
| 질소 | $\mathrm{N_2}$ |
| 얼음 | $\mathrm{H_2O}(s)$ |
| 물 | $\mathrm{H_2O}(l)$ |
| 수증기 | $\mathrm{H_2O}(g)$ |
| 염산 | $\mathrm{HCl}$ |
| 황화수소 | $\mathrm{H_2S}$ |
| 암모니아 | $\mathrm{NH_3}$ |
| 드라이아이스 | $\mathrm{CO_2}(s)$ |
¶ IUPAC 명명법
관용명을 통해 수많은 화합물을 표기하는 데 한계가 있어 국제 순수 및 응용 화학 연합()에서 고안한 체계적인 명명법(이름을 짓는 방법)이다.
¶ 홑원소 물질의 명명법
원소명 앞에 개수를 나타내는 접두어를 붙여 명명한다.
| 접두어 | 의미 |
|---|---|
| 일(mono) | $1$ |
| 이(di) | $2$ |
| 삼(tri) | $3$ |
| 사(tetra) | $4$ |
| 오(penta) | $5$ |
| 육(hexa) | $6$ |
| 칠(hepta) | $7$ |
| 팔(octa) | $8$ |
| 구(nona) | $9$ |
| 십(deca) | $10$ |
¶ 홑원소 물질의 명명 예시
는 일질소, 는 이질소, 는 삼질소이다.
¶ 이성분 분자성 화합물의 명명법
두 가지 원소로 이루어진 공유 결합 화합물을 이성분 분자성 화합물이라 하는데, 아래 규칙에 따라 명명한다.
. 음이온성 원소를 먼저 쓰고, 음이온성 원소 끝에 ‘화’를 붙인다.
. 양이온성 원소는 음이온성 원소 뒤에 쓴다.
. 홑원소 물질과 같이 원소명 앞에 개수를 나타내는 접두어를 붙인다. 개수가 개인 경우 생략할 수 있다.
. 산소나 염소와 같이 음이온성 원소의 이름이 ‘소’로 끝날 때 원소명의 ‘소’를 생략한다.
¶ 양이온성 원소와 음이온성 원소 파악
주기율표상에서 오른쪽 위에 있을수록 전자를 끌어당기는 능력이 좋아 음이온에 유사하고, 반대로 주기율표상에서 왼쪽 아래에 있을수록 전자를 끌어당기는 능력이 나빠 양이온에 유사하다.
따라서 상대적으로 주기율표상에서 오른쪽 위에 있는 원소가 음이온성 원소에 해당하고, 나머지 원소는 상대적으로 양이온성 원소가 된다.
¶ 이성분 분자성 화합물의 명명 예시
-
의 명명:
주기율표상에서 (플루오린)는 (황)보다 오른쪽 위에 위치하므로 는 음이온성 원소, 는 상대적으로 양이온성 원소에 해당한다.
또한 한 분자는 개, 개로 이루어지므로 는 사플루오린화 황이라 한다.
-
의 명명:
주기율표상에서 (산소)는 (탄소)보다 오른쪽에 위치하므로 는 음이온성 원소, 는 상대적으로 양이온성 원소에 해당한다.
또한 한 분자는 개, 개로 이루어지므로 는 이산화 탄소라 한다.
음이온성 원소의 이름이 ‘소’로 끝날 때 원소명의 ‘소’를 생략하므로 ‘이산소화 탄소’가 아닌 ‘이산화 탄소’이다.
¶ 이온 결합 화합물의 명명
이온 결합 화합물은 아래 규칙에 따라 명명한다.
. 이성분 분자성 화합물과 유사하게 음이온을 먼저 쓰고 음이온 끝에 ‘화’를 붙인 뒤, 양이온을 음이온 뒤에 쓴다.
. 원자가 전자 수에 따라 형성되는 이온의 전하량을 예상할 수 있으므로 분자성 화합물과 달리 원소명 앞에 개수를 나타내는 접두어를 사용하지 않는다.
. 이온을 형성할 때 다양한 전하량을 가질 수 있는 원소(, , 등)의 경우 괄호 안에 로마 숫자를 써서 전하량을 표시한다.
| 로마자 | 값 |
|---|---|
| $Ⅰ$ | $1$ |
| $Ⅱ$ | $2$ |
| $Ⅲ$ | $3$ |
| $Ⅳ$ | $4$ |
¶ 이온 결합 화합물의 명명 예시
-
의 명명:
원소명 앞에 개수를 나타내는 접두어를 사용하지 않으므로 ‘삼염화 알루미늄’이 아닌 ‘염화 알루미늄’이다.
-
의 명명:
은 다양한 전하를 가질 수 있으므로 에서 의 전하량을 구한 뒤 로마자로 표기해야 한다.
은 족 원소이므로 이온 형성 시 전하를 가지게 되며, 크로뮴 이온과 염화 이온이 의 비율로 결합하므로 전기적으로 중성을 이루기 위해선 크로뮴 이온의 전하량은 이어야 함을 알 수 있다.
따라서 는 염화 크로뮴()이다.
¶ 다원자 이온
여러 원자가 공유 결합하여 전체적으로 전하를 띠는 이온이다.
다원자 이온을 이루는 원자들은 결합이 강하여 다른 물질과 반응할 때도 결합을 그대로 유지하는 경향이 있어 마치 하나의 원자로 이루어진 이온처럼 행동한다.
¶ 다원자 이온의 명명
다원자 이온은 보편적인 명명법이 없어 기본적으로 암기가 필요하다.
대부분의 다원자 음이온은 ‘-산’ 또는 ‘-화’로 끝난다.
다원자 음이온 중 한 원자가 서로 다른 수의 산소와 결합하여 형성한 이온을 산소산 음이온이라 하는데,
아황산 이온과 황산 이온처럼 한 계열에 두 가지 산소산 음이온만 있을 때,
적은 수의 산소를 갖는 다원자 이온명 앞에 ‘아-’를 붙인다.
하이포염소산, 아염소산, 염소산, 과염소산처럼 한 계열에 네 가지 산소산 음이온이 있을 때,
가장 적은 산소 수를 갖는 화합물에는 ‘하이포-’를, 그 다음으로 적은 산소 수를 갖는 화합물에는 ‘아-’를,
가장 많은 산소 수를 갖는 화합물에는 ‘과-’를 다원자 이온명 앞에 붙인다.
| 화학식 | 이름 | 화학식 | 이름 |
|---|---|---|---|
| 양이온 | $1$가 음이온 | ||
| $\mathrm{NH_4}^{+}$ | 암모늄 이온 | $\mathrm{NO_2}^{-}$ | 아질산 이온 |
| $1$가 음이온 | $\mathrm{NO_3}^{-}$ | 질산 이온 | |
| $\mathrm{CH_3CO_2}^{-}$ | 아세트산 이온 | $2$가 음이온 | |
| $\mathrm{CN}^{-}$ | 사이안화 이온 | $\mathrm{CO_3}^{2-}$ | 탄산 이온 |
| $\mathrm{ClO}^{-}$ | 하이포염소산 이온 | $\mathrm{CrO_4}^{2-}$ | 크로뮴산 이온 |
| $\mathrm{ClO_2}^{-}$ | 아염소산 이온 | $\mathrm{Cr_2O_7}^{2-}$ | 다이크로뮴산 이온 |
| $\mathrm{ClO_3}^{-}$ | 염소산 이온 | $\mathrm{O_2}^{2-}$ | 과산화 이온 |
| $\mathrm{ClO_4}^{-}$ | 과염소산 이온 | $\mathrm{HPO_4}^{2-}$ | 인산수소 이온 |
| $\mathrm{H_2PO_4}^{-}$ | 인산이수소 이온 | $\mathrm{SO_3}^{2-}$ | 아황산 이온 |
| $\mathrm{HCO_3}^{-}$ | 탄산수소 이온 | $\mathrm{SO_4}^{2-}$ | 황산 이온 |
| $\mathrm{HSO_4}^{-}$ | 황산수소 이온 | $\mathrm{S_2O_3}^{2-}$ | 싸이오황산 이온 |
| $\mathrm{OH}^{-}$ | 수산화 이온 | $3$가 음이온 | |
| $\mathrm{MnO_4}^{-}$ | 과망가니즈산 이온 | $\mathrm{PO_4}^{3-}$ | 인산 이온 |
¶ 다원자 이온 결합 화합물의 명명 예시
- 의 명명:
구리 이온과 탄산이 결합된 이성분 이온 결합 화합물이므로, 다원자 음이온인 탄산을 먼저 쓰고 구리를 나중에 적는다.
또한 구리 이온의 전하량은 이므로 괄호 안에 로마자 를 적는다.
따라서 는 ‘탄산 구리()’이다.
¶ 적용 문항
¶ 1번 문항

정답: $5$
ㄱ. (가)에 들어있는 물질은 한 종류이므로 순물질이며, 는 (탄소)와 (산소) 가지 이상의 원소로 구성되어 있으므로 화합물이다. (O)
ㄴ. (나)에 들어있는 물질은 한 종류이므로 순물질이며, (헬륨)는 가지 원소로 구성되어 있으므로 홑원소 물질이다. (O)
ㄷ. 꼭지를 연 후 충분한 시간이 지나면 와 가 섞이기 때문에 (가)와 (나)에 들어있는 물질은 와 로 두 종류 이상이므로 혼합물에 해당한다. (O)
따라서 답은 번이다.
¶ 2번 문항
정답: $3$
㉠은 금속과 비금속 원소가 결합하여 형성된 이온 결합 물질이며, 이온 결합 물질은 원소명 앞에 개수를 나타내는 접두어를 사용하지 않으므로 ㉠의 명명법은 ‘염화 칼슘’이다.
㉡은 금속과 비금속 원소가 결합하여 형성된 이온 결합 물질이며, 는 다양한 전하량을 가질 수 있으므로 의 전하량을 구한 뒤 로마자로 표기해야 한다.
는 족 원소이므로 이온 형성 시 전하를 가지게 되며, 철 이온과 산화 이온이 의 비율로 결합하므로 전기적으로 중성을 이루기 위해선 철 이온의 전하량은 이어야 함을 알 수 있다.
그러므로 의 명명법은 ‘산화 철()’이다.
따라서 답은 번이다.



