¶ 지식 정보
¶ 해리
물질이 원자나 분자 또는 이온 등으로 분리되는 현상이다.
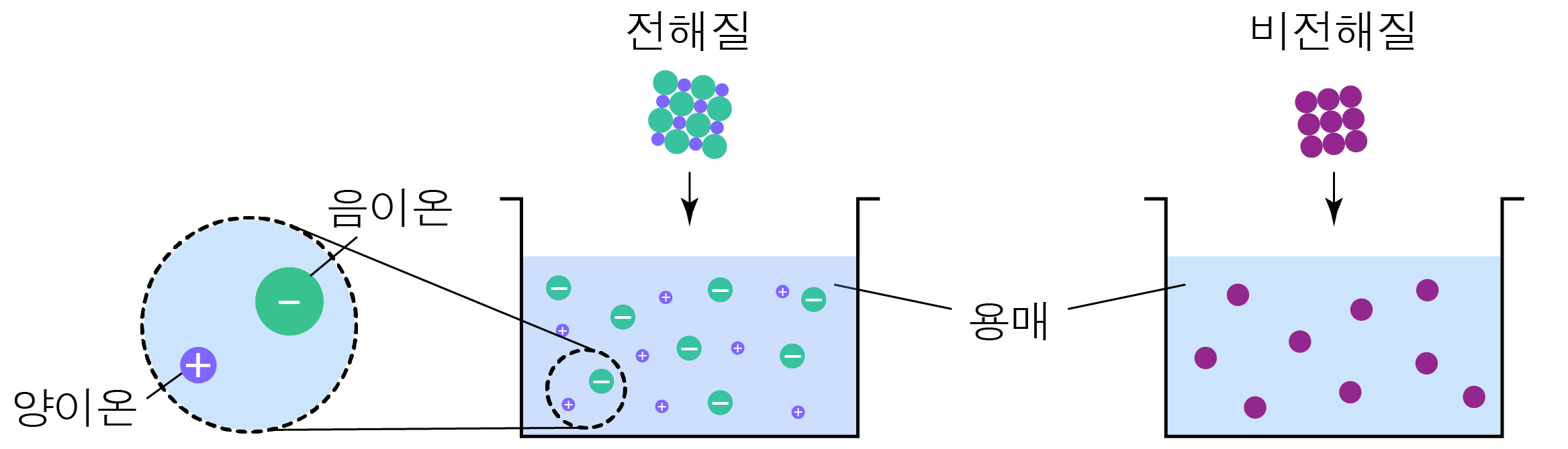
¶ 전해질과 비전해질
전해질은 용매에 녹을 때 이온으로 해리되는 물질을,
비전해질은 용매에 녹을 때 이온으로 해리되지 않는 물질이다.
전해질 수용액은 자유롭게 이동할 수 있는 이온을 가지므로 전기 전도성이 있으며,
반대로 비전해질 수용액은 자유롭게 이동할 수 있는 이온이 없어 전기 전도성이 없다.
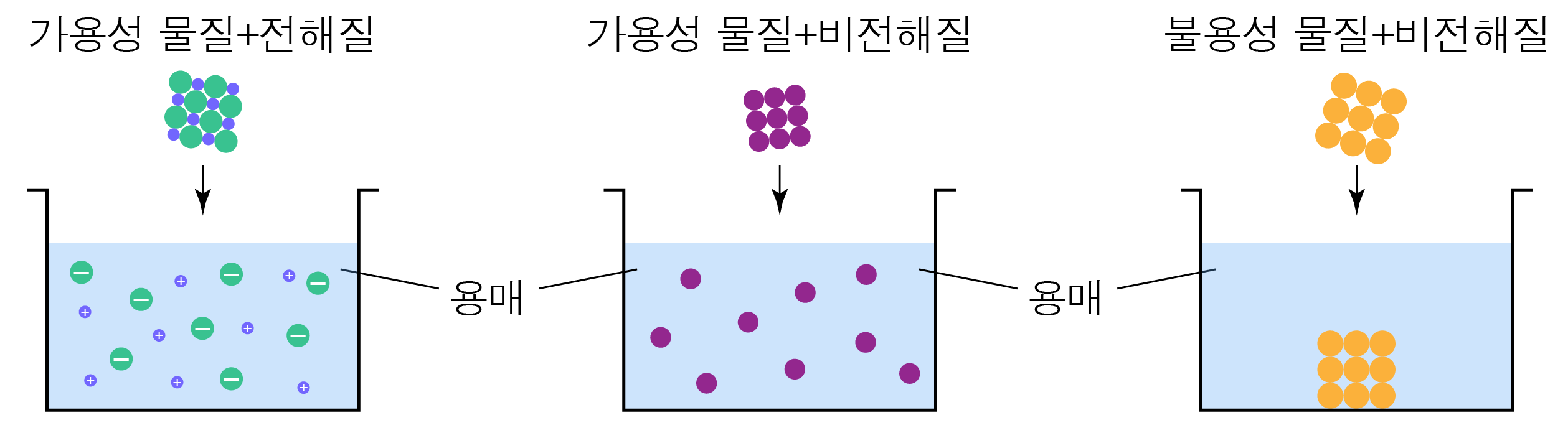
¶ 가용성과의 차이
가용성은 물질이 특정 용매에 잘 녹는 성질을 의미하고,
전해질은 용매에 녹을 때 해리되는 물질을 의미하므로 서로 다른 개념이다.
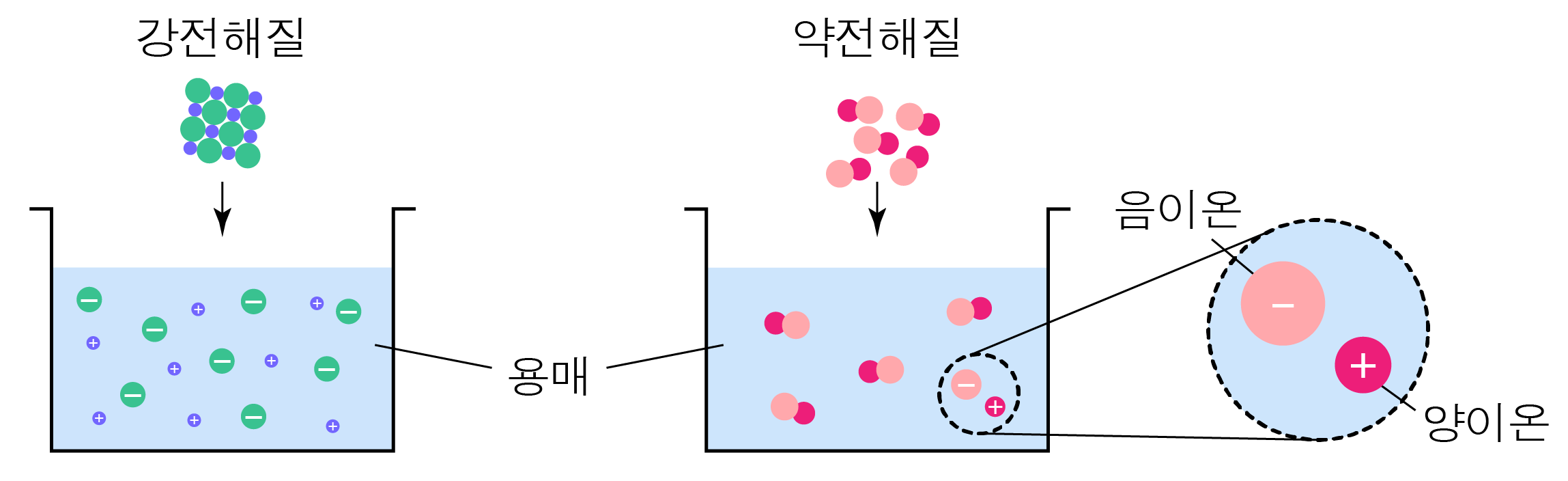
¶ 강전해질과 약전해질
강전해질은 용매에 녹을 때 대부분 이온으로 해리되는 물질을,
약전해질은 용매에 녹을 때 일부만 이온으로 해리되는 물질을 의미한다.
¶ 전해질의 분류
용매가 물인 경우 대표적인 강전해질, 약전해질, 비전해질은 아래 표와 같다.
| 강전해질 | 약전해질 | 비전해질 |
|---|---|---|
| $\mathrm{HCl},\,\mathrm{HBr},\,\mathrm{HI}$ | $\mathrm{CH_3CO_2H}$ | $\mathrm{H_2O}$ |
| $\mathrm{HClO_4}$ | $\mathrm{HF}$ | $\mathrm{CH_3OH}$ |
| $\mathrm{HNO_3}$ | $\mathrm{HCN}$ | $\mathrm{C_2H_5OH}$ |
| $\mathrm{H_2SO_4}$ | $\mathrm{C_{12}H_{22}O_{11}}$(설탕) | |
| $\mathrm{KBr}$ | 대부분의 탄소 화합물 | |
| $\mathrm{NaCl}$ | ||
| $\mathrm{NaOH},\,\mathrm{KOH}$ | ||
| 기타 수용성 이온 결합 화합물 |
¶ 적용 문항
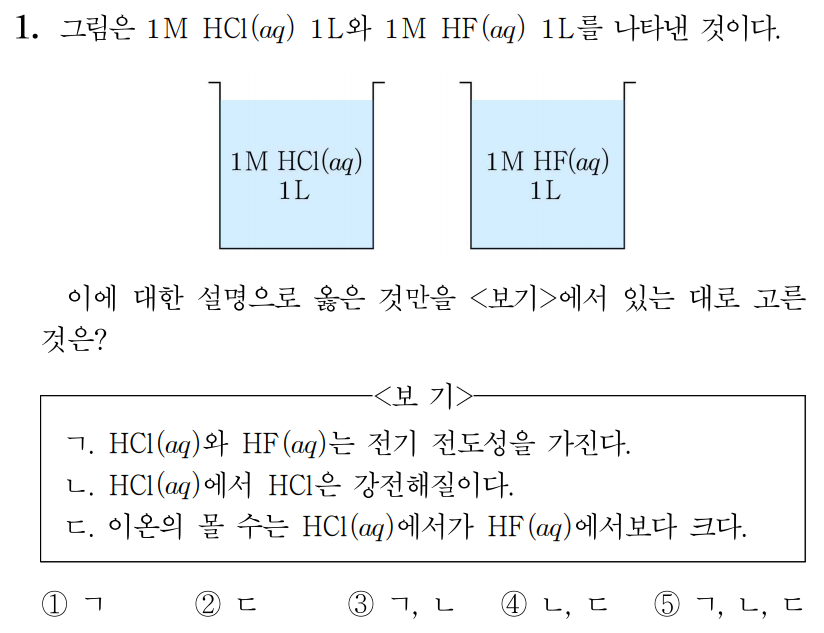
¶ 1번 문항
정답: $5$
ㄱ. 과 는 모두 물에서 전해질에 해당하므로 과 를 녹인 수용액은 전기 전도성을 가진다. (O)
ㄴ. 용매가 물일 경우(수용액일 경우) 은 강전해질이다. (O)
ㄷ. 와 의 몰 농도와 용액의 부피는 각각 같으므로 용질의 몰 수가 같다. 이때 은 물에서 대부분 이온으로 해리되는 강전해질이고, 는 물에서 일부만 이온으로 해리되는 약전해질이므로 이온의 몰 수는 에서가 에서보다 크다. (O)
따라서 답은 번이다.
¶ 2번 문항
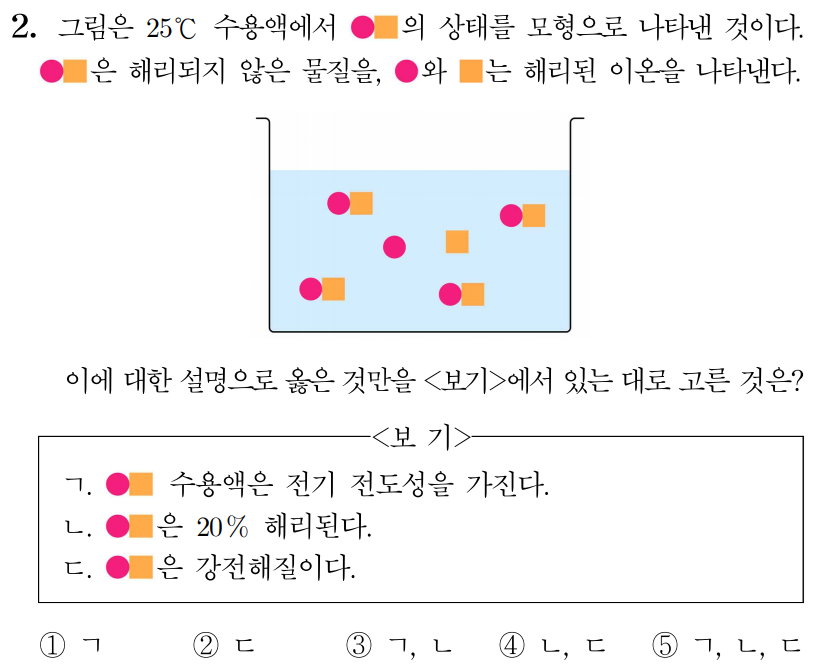
정답: $3$
ㄱ.  의 일부가 해리되어 이온을 형성하므로
의 일부가 해리되어 이온을 형성하므로  수용액은 전기 전도성을 가진다. (O)
수용액은 전기 전도성을 가진다. (O)
ㄴ. 개의  중 개만 해리되었으므로 해리된다. (O)
중 개만 해리되었으므로 해리된다. (O)
ㄷ.  는 만 해리되므로 약전해질이다. (X)
는 만 해리되므로 약전해질이다. (X)
따라서 답은 번이다.


