¶ 지식 정보
¶ 이온화 에너지
기체 상태의 원자 또는 이온 에서 전자 을 떼어 내는 데 필요한 에너지이다. 단위는 주로 을 사용한다.
¶ 제n 이온화 에너지
상대적 전하가 인 원자 에서 전자 을 떼어 내는 데 필요한 에너지이다. (은 자연수이다.)
¶ 제n 이온화 에너지 예시
-
임의의 중성 원자(상대적 전하가 이므로 ) 에서 전자 을 떼어 내는 데 필요한 에너지: 제 이온화 에너지
-
(상대적 전하가 이므로 ) 에서 전자 을 떼어 내는 데 필요한 에너지: 제 이온화 에너지
-
(상대적 전하가 이므로 ) 에서 전자 을 떼어 내는 데 필요한 에너지: 제 이온화 에너지
¶ 제1 이온화 에너지의 비교
- 같은 주기에서 족에서 족으로, 족에서 족으로 원자 번호가 증가하는 경우를 제외할 때:
원자 번호가 증가할 때 전자 껍질의 수는 그대로지만 원자가 전자가 느끼는 유효 핵전하가 증가한다.
유효 핵전하가 클수록 핵이 전자를 당기는 힘이 커지므로 전자를 떼어 내기 어려워져 이온화 에너지가 커진다.
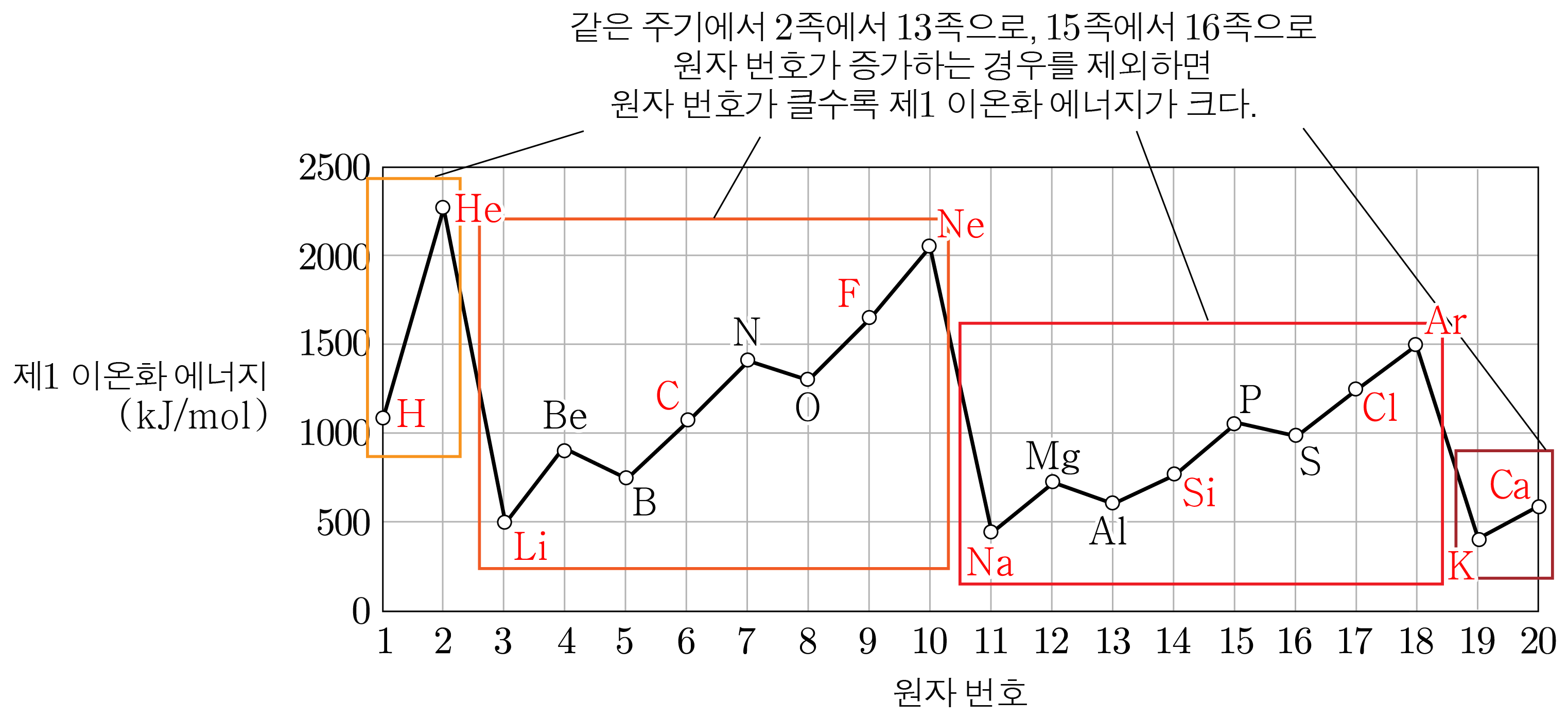
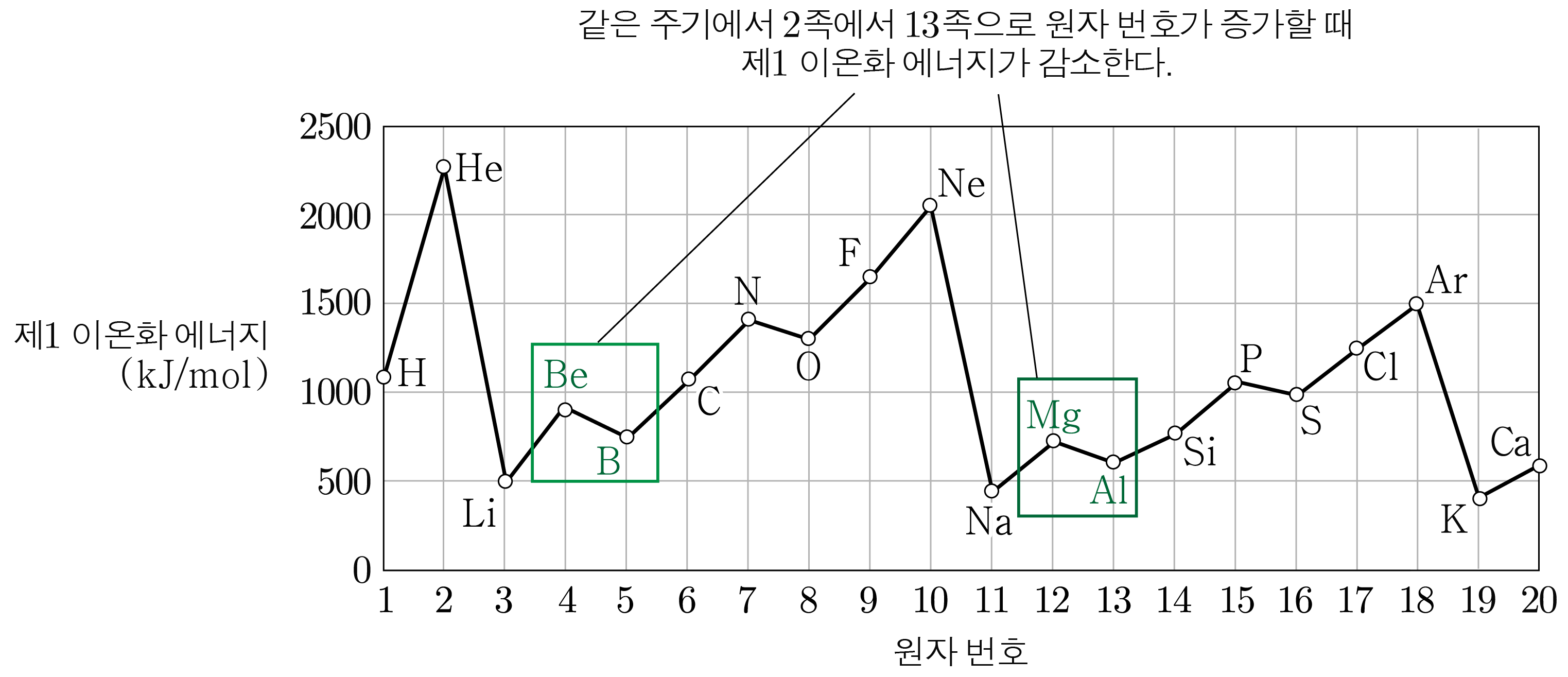
- 같은 주기에서 족에서 족으로 원자 번호가 증가할 때:
주양자수가 같을 때 오비탈에 있는 전자는 오비탈에 있는 전자보다 원자핵에 더 멀리 떨어져 있어 원자핵이 당기는 힘이 작아 제거하기 쉬우므로 이온화 에너지가 작아진다.
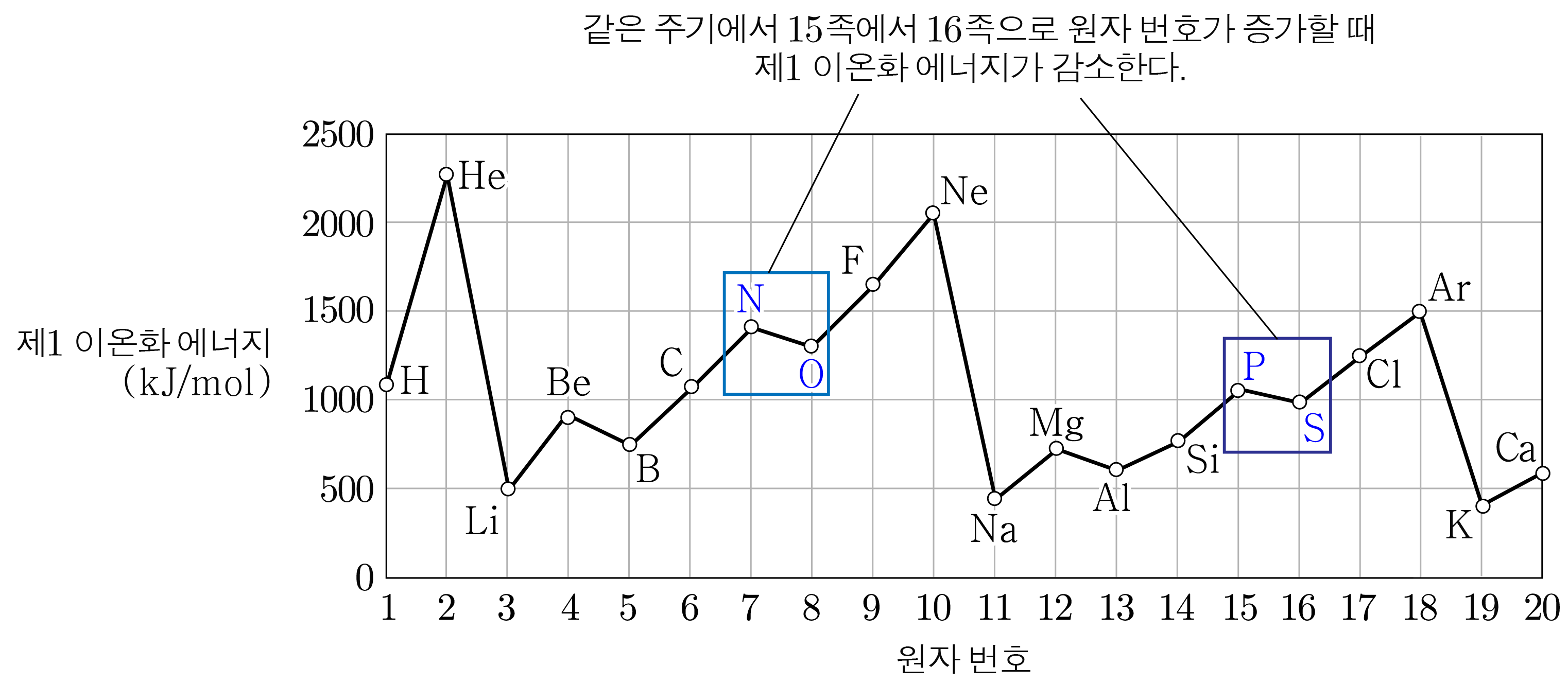
- 같은 주기에서 족에서 족으로 원자 번호가 증가할 때:
족 원소는 오비탈 세 개 모두 전자가 하나씩 들어가 있는 반면, 족 원소는 오비탈 하나에 전자가 개 들어가 있다.
전자끼리는 서로 밀어내므로 가능한 멀리 떨어지는 경향이 있어 오비탈을 세 개 모두 전자로 하나씩 채운 경우보다 오비탈 하나에 전자가 개 들어가 있는 경우가 전자를 제거하기 쉽다.
따라서 이온화 에너지가 작아진다.
- 족 원소에서 다음 주기의 족 원소로 원자 번호가 증가할 때:
전자 껍질 수가 증가하여 원자핵과 원자가 전자 사이의 거리가 멀어지므로 이온화 에너지가 크게 감소한다.
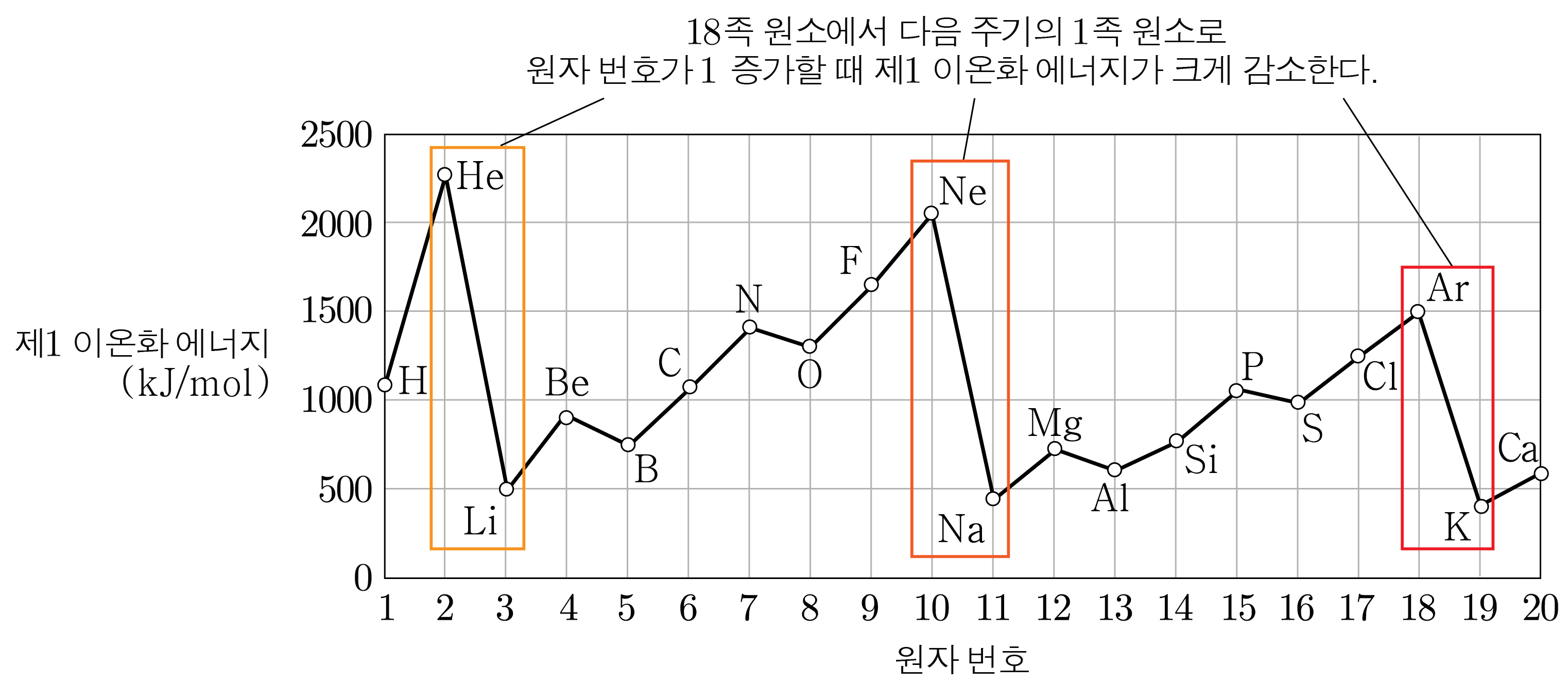
- 같은 족에서 원자 번호가 증가할 때:
전자 껍질 수가 증가하여 원자핵과 원자가 전자 사이의 거리가 멀어지므로 이온화 에너지가 감소한다.
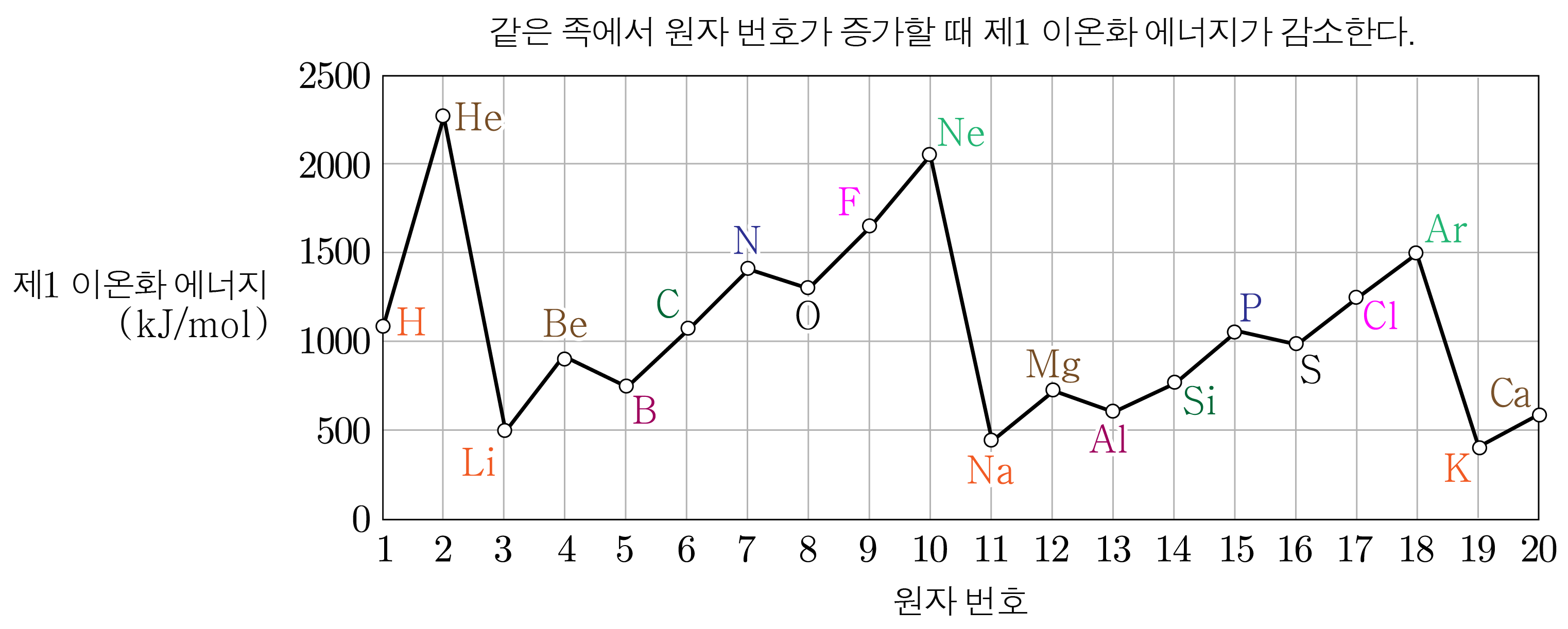
앞선 내용을 바탕으로 각 주기별 제 이온화 에너지를 비교하면 아래와 같다.
주기:
주기:
주기: $ \mathrm{Ar}$
¶ 제n 이온화 에너지의 변화
전자 수가 감소할수록 가려막기 효과가 감소하여 유효 핵전하가 증가한다.
이로 인해 전자를 떼어 낼수록 다음 전자를 떼어내기 어려워지므로 이 커질수록 이온화 에너지는 증가한다.
원자가 전자를 모두 떼어 내면 전자 껍질 수가 감소하여 그 다음 전자는 직전 전자에 비해 원자핵과 전자 사이의 거리가 훨씬 가까워
이온화 에너지가 배 이상 급격히 증가한다.
¶ 제n 이온화 에너지의 변화 예시
다음은 주기 원소 의 이온화 에너지를 나타낸 것이다. 이를 통해 를 구해보자. (단, 는 임의의 원소이다.)
| $\circ\,$제$1$ 이온화 에너지: $578\,\mathrm{kJ/mol}$ $\circ\,$제$2$ 이온화 에너지: $1817\,\mathrm{kJ/mol}$ $\circ\,$제$3$ 이온화 에너지: $2745\,\mathrm{kJ/mol}$ $\circ\,$제$4$ 이온화 에너지: $11577\,\mathrm{kJ/mol}$ |
제 이온화 에너지에서 제 이온화 에너지로 갈 때 배 이상 급격히 증가하였으므로 는 개의 원자가 전자를 가진다.
따라서 는 주기이면서 족 원소인 이다.
¶ 전자 친화도
기체 상태의 중성 원자 에서 전자 을 추가할 때 일어나는 에너지 변화이다.
에너지의 부호가 양인 경우는 에너지 흡수를, 음인 경우는 에너지 방출을 의미한다.
¶ 전자 친화도의 비교
-
족 원소에 전자를 추가할 경우:
족 원소는 오비탈에 이미 전자가 차 있기 때문에 전자는 오비탈에 들어가야 하는데, 오비탈은 오비탈보다 에너지 준위가 높으므로 양의 부호이거나 인 전자 친화도를 갖는다. -
족 원소에 전자를 추가할 경우:
족 원소는 이미 옥텟 규칙을 만족하여 매우 안정하므로 양의 부호이거나 인 전자 친화도를 갖는다.
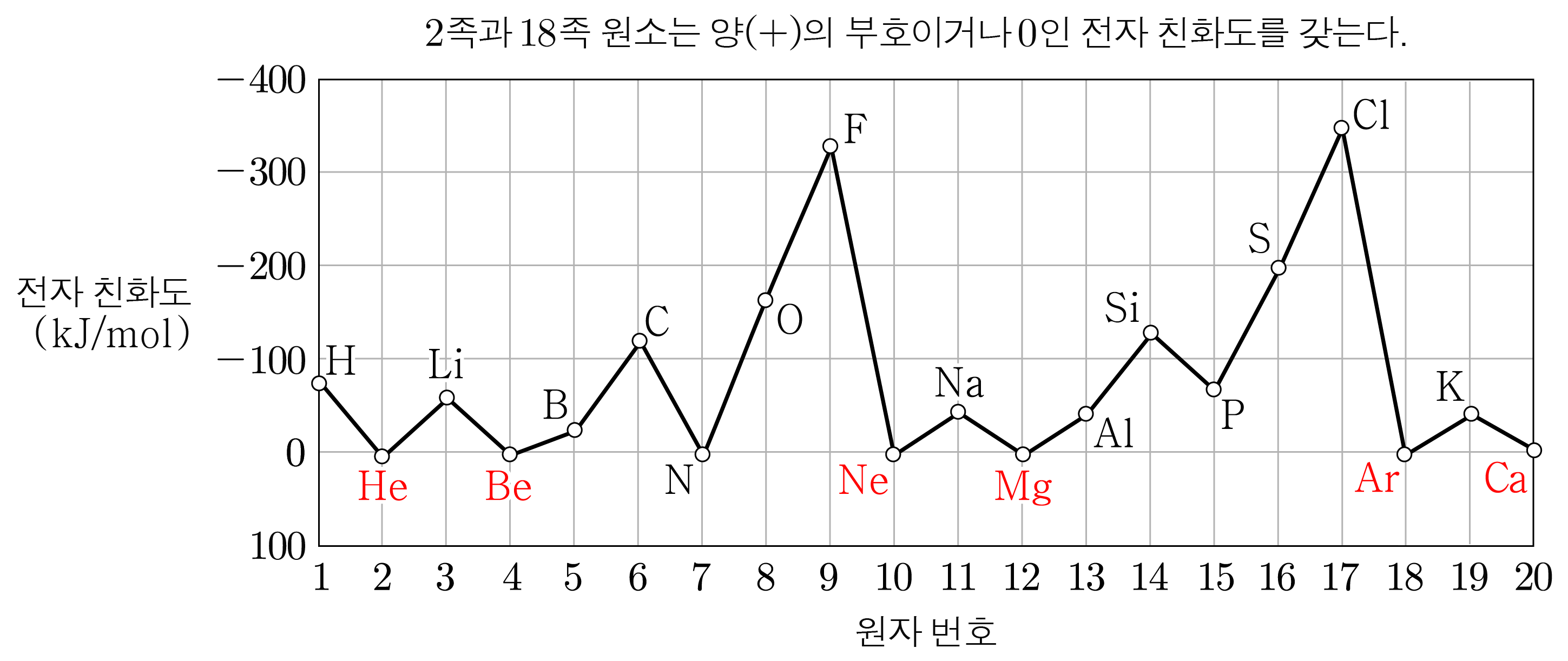
그래프의 세로축에서 위쪽이 음수, 아래쪽이 양수임에 주의한다.
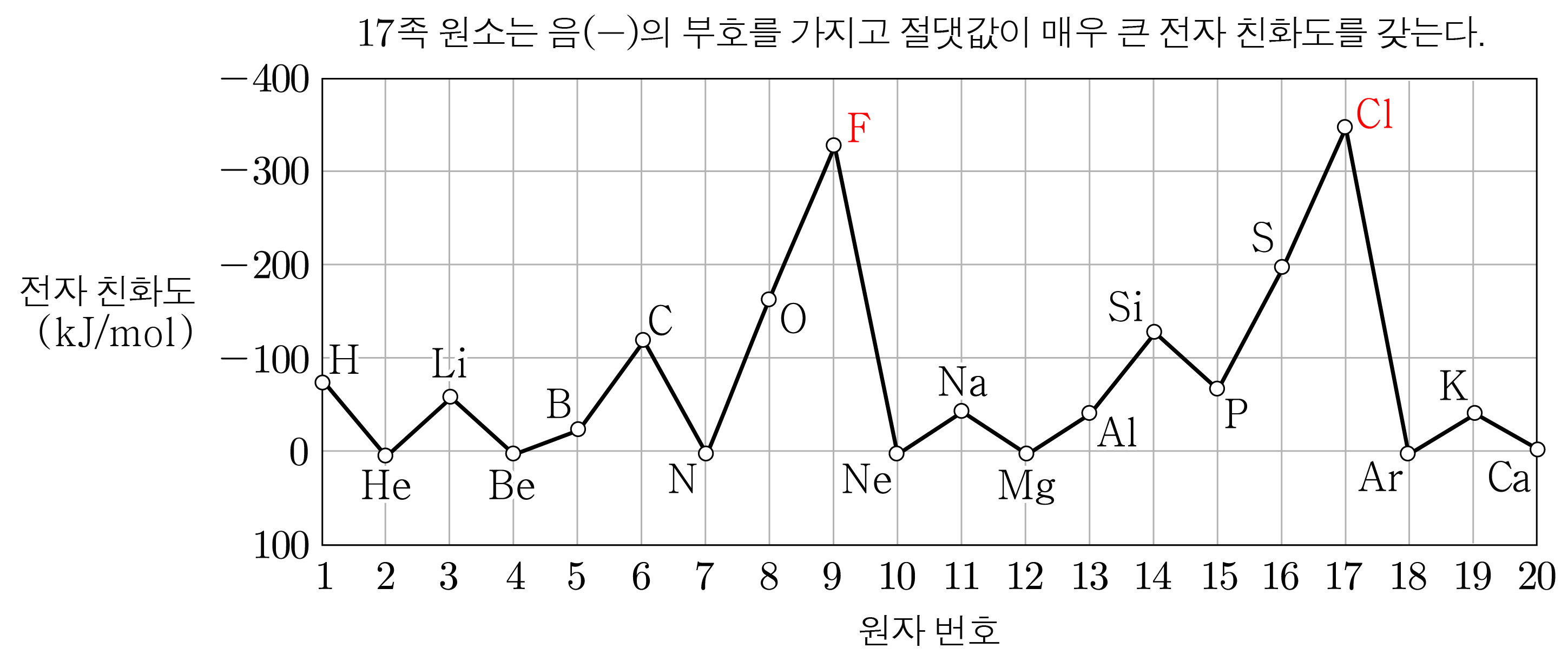
- 족 원소에 전자를 추가할 경우:
옥텟 규칙을 만족하여 매우 안정해지므로 음의 부호를 가지고 절댓값이 매우 큰 전자 친화도를 갖는다.
¶ 적용 문항
¶ 1번 문항
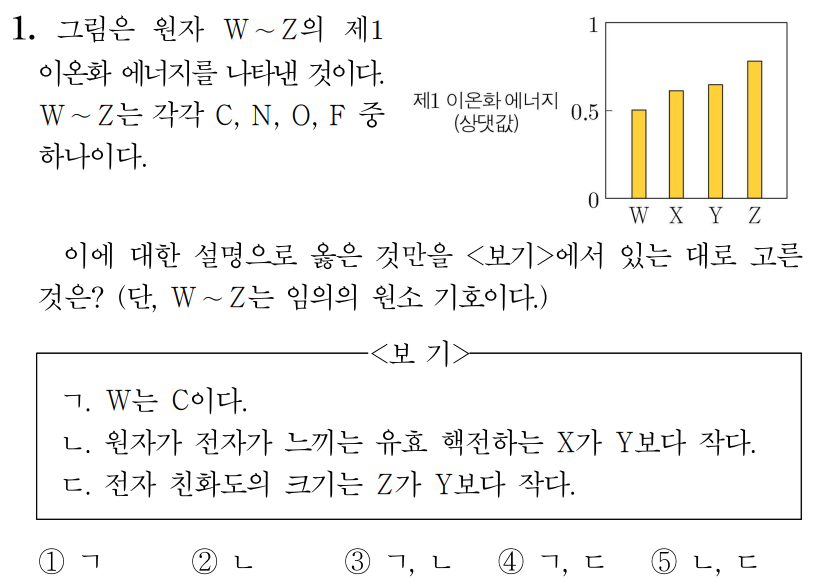
정답: $1$
ㄱ. 주기 원소의 제 이온화 에너지를 비교하면 이므로
는 각각 이다. (O)
ㄴ. 같은 주기에서 원자 번호가 클수록 원자가 전자가 느끼는 유효 핵전하는 증가하므로 가 보다 크다. (X)
ㄷ. 족 원소에 전자를 추가할 경우 옥텟 규칙을 만족하여 매우 안정해지므로
음의 부호를 가지고 절댓값이 매우 큰 전자 친화도를 갖는다.
그러므로 전자 친화도의 크기는 족 원소인 가 보다 크다. (X)
따라서 답은 번이다.
¶ 2번 문항
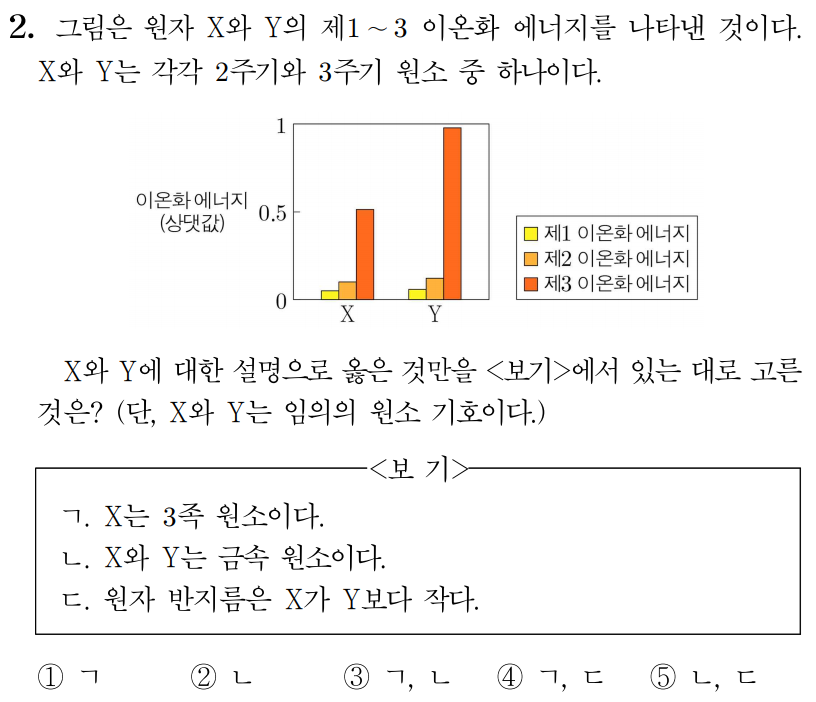
정답: $2$
ㄱ. 와 는 모두 제 이온화 에너지가 제 이온화 에너지로 갈 때 배 이상 급격히 증가하였으므로
와 는 개의 원자가 전자를 가지는 족 원소이다. (X)
ㄴ. 같은 족에서 원자 번호가 증가할 때 전자 껍질 수가 증가하여 원자핵과 전자 사이의 거리가 멀어지므로 제 이온화 에너지가 감소한다.
제 이온화 에너지는 가 보다 약간 작으므로 는 주기 원소인 는 주기 원소인 이며, 와 는 금속 원소이다. (O)
ㄷ. 같은 족에서 원자 번호가 증가할 때 전자 껍질 수가 증가하여 원자 반지름이 커지므로 가 보다 크다. (X)
따라서 답은 번이다.


