¶ 지식 정보
¶ 화학 모형
원자, 이온, 분자 등을 쉽게 이해하고 표현할 수 있도록 만든 모형이다.
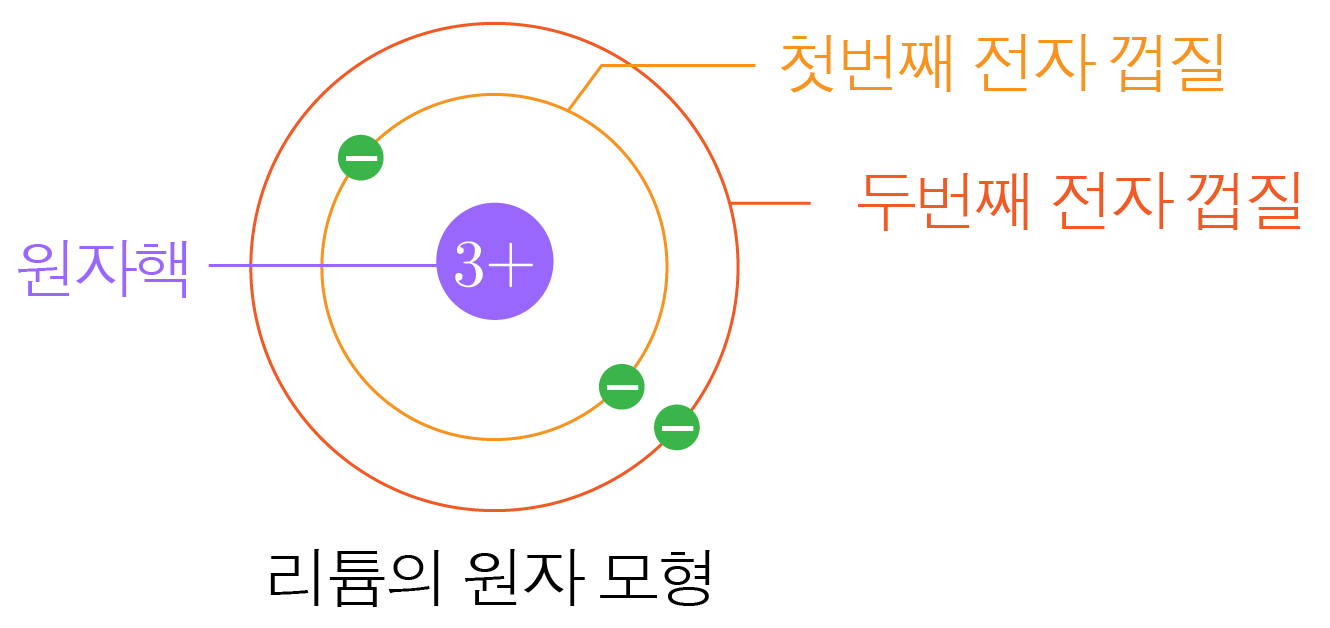
주로 아래 그림과 같이 보어의 원자 모형이 쓰인다.
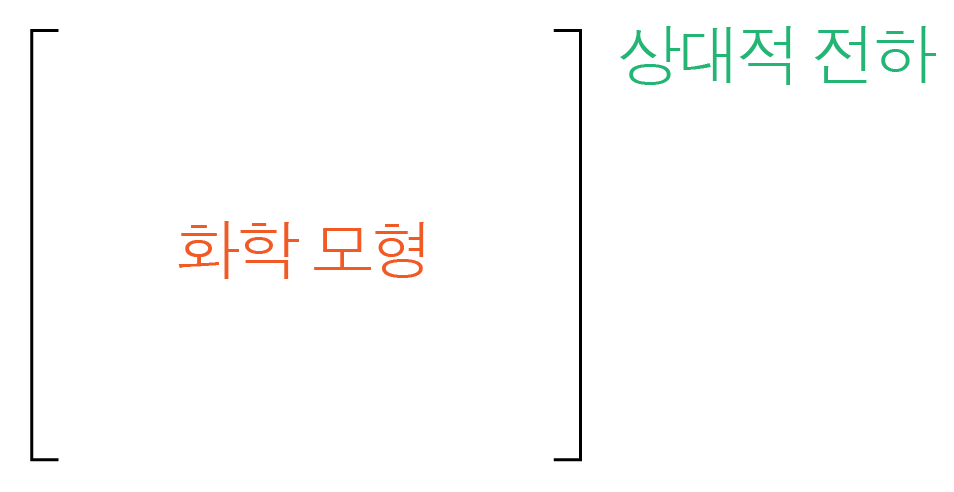
¶ 이온을 화학 모형으로 나타내는 방법
화학 모형을 큰 대괄호 안에 그린 후, 상대적 전하를 대괄호의 오른쪽 위에 표기한다.
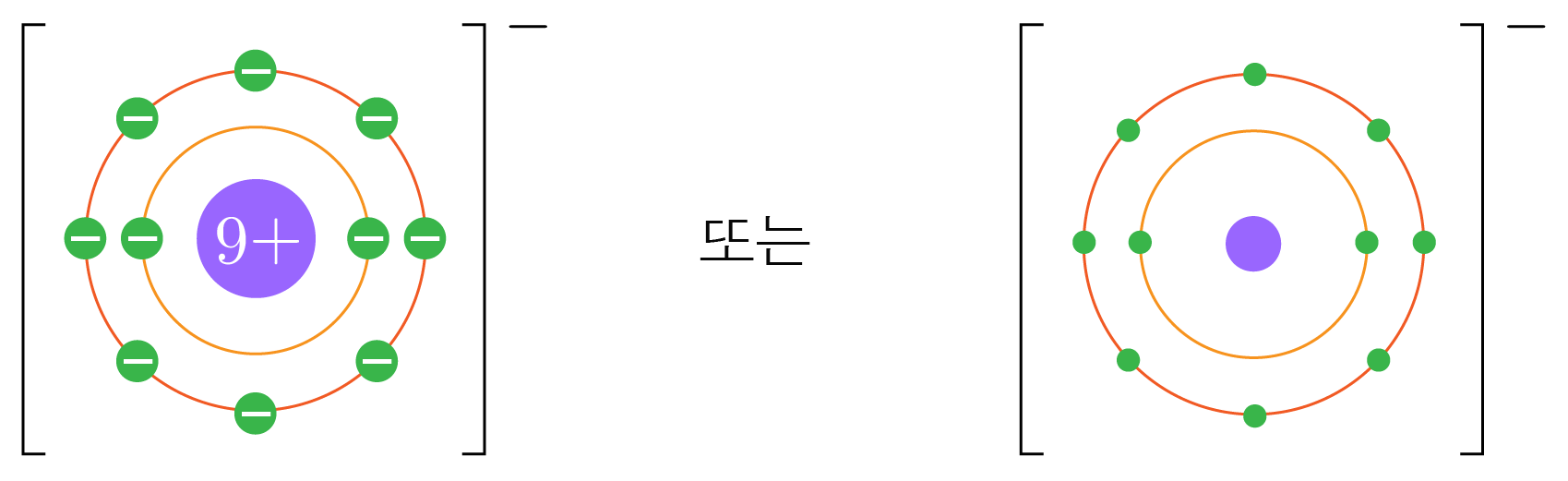
¶ 이온을 화학 모형으로 나타내는 방법 예시
예시) 를 화학 모형으로 그려보자.
는 원자 번호 번이므로 중성 원자는 개의 전자를 갖는다.
는 에서 전자 개가 증가한 것이므로 는 개의 전자를 갖는다.
따라서 를 화학 모형으로 그리면 아래 그림과 같다.
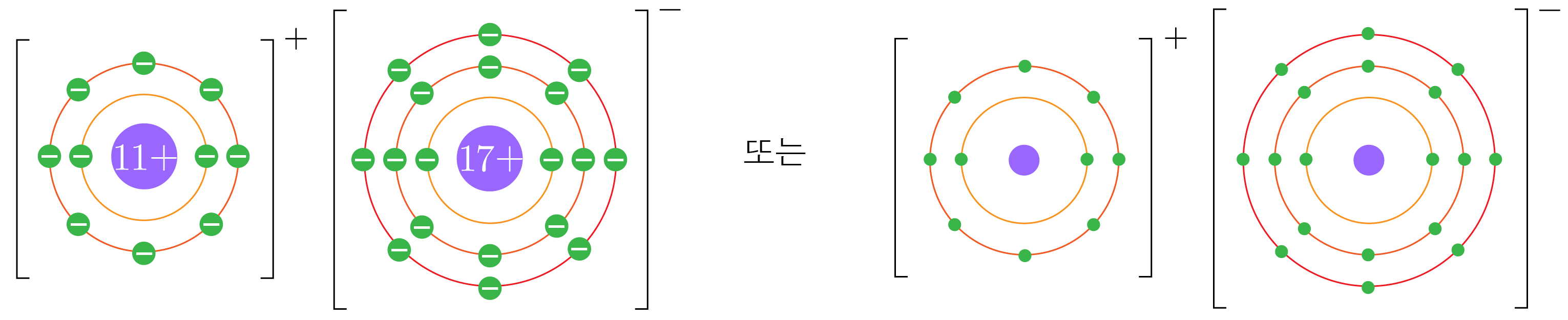
화학 모형에서 원자핵과 전자의 전하 표기는 생략 가능하다.
예시) 을 화학 모형으로 그려보자.
은 와 가 결합하여 만들어지므로 와 모형을 차례로 그린다.
는 원자 번호 번이므로 중성 원자는 개의 전자를 갖는다.
는 에서 전자 개가 감소한 것이므로 는 개의 전자를 갖는다.
은 원자 번호 번이므로 중성 원자는 개의 전자를 갖는다.
는 에서 전자 개가 증가한 것이므로 는 개의 전자를 갖는다.
따라서 을 화학 모형으로 그리면 아래 그림과 같다.
¶ 원자 반지름
인접한 같은 종류의 두 원자의 원자핵 사이 거리의 절반이다.
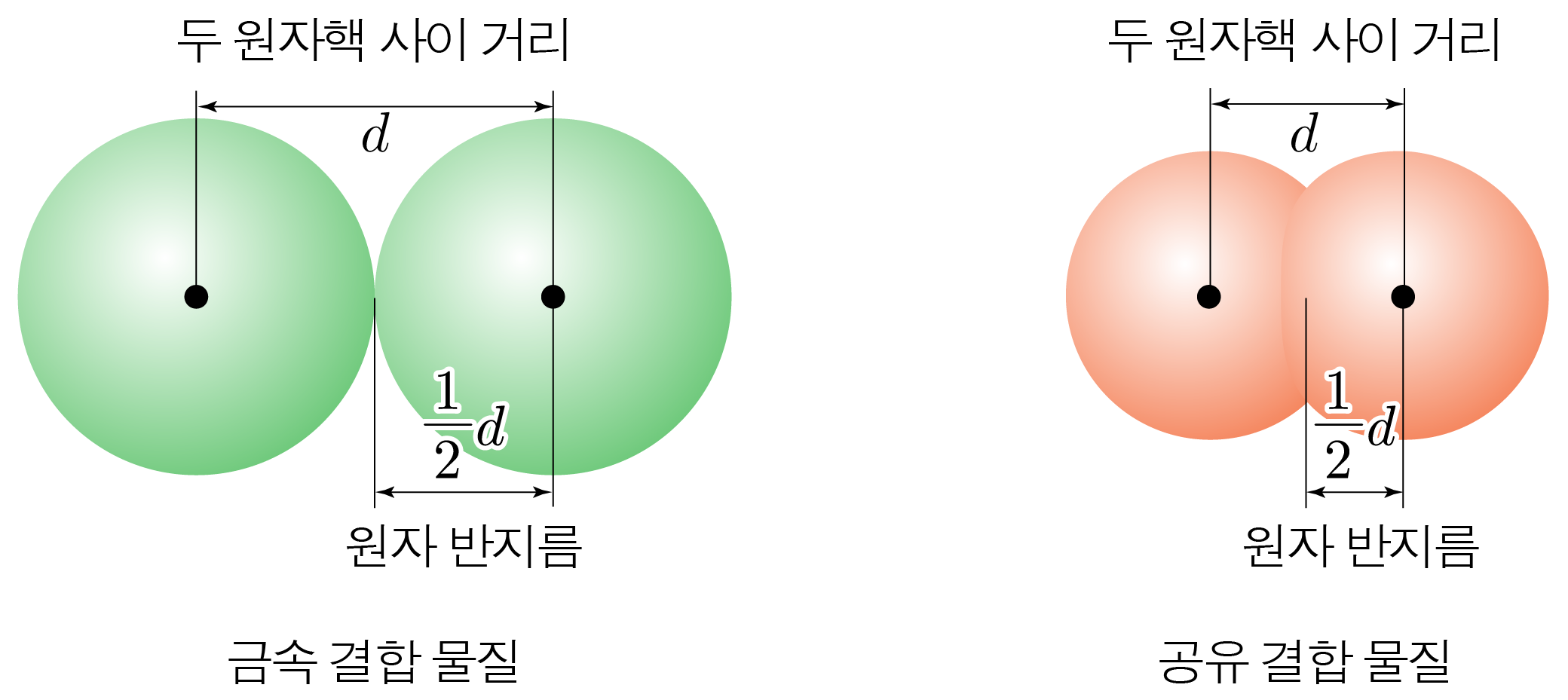
¶ 원자 반지름의 비교
- 같은 주기에서 원자 번호가 증가할 때:
전자 껍질의 수는 그대로지만 원자가 전자가 느끼는 유효 핵전하가 증가한다.
유효 핵전하가 클수록 핵이 전자를 당기는 힘이 커지므로 원자 반지름이 작아진다.
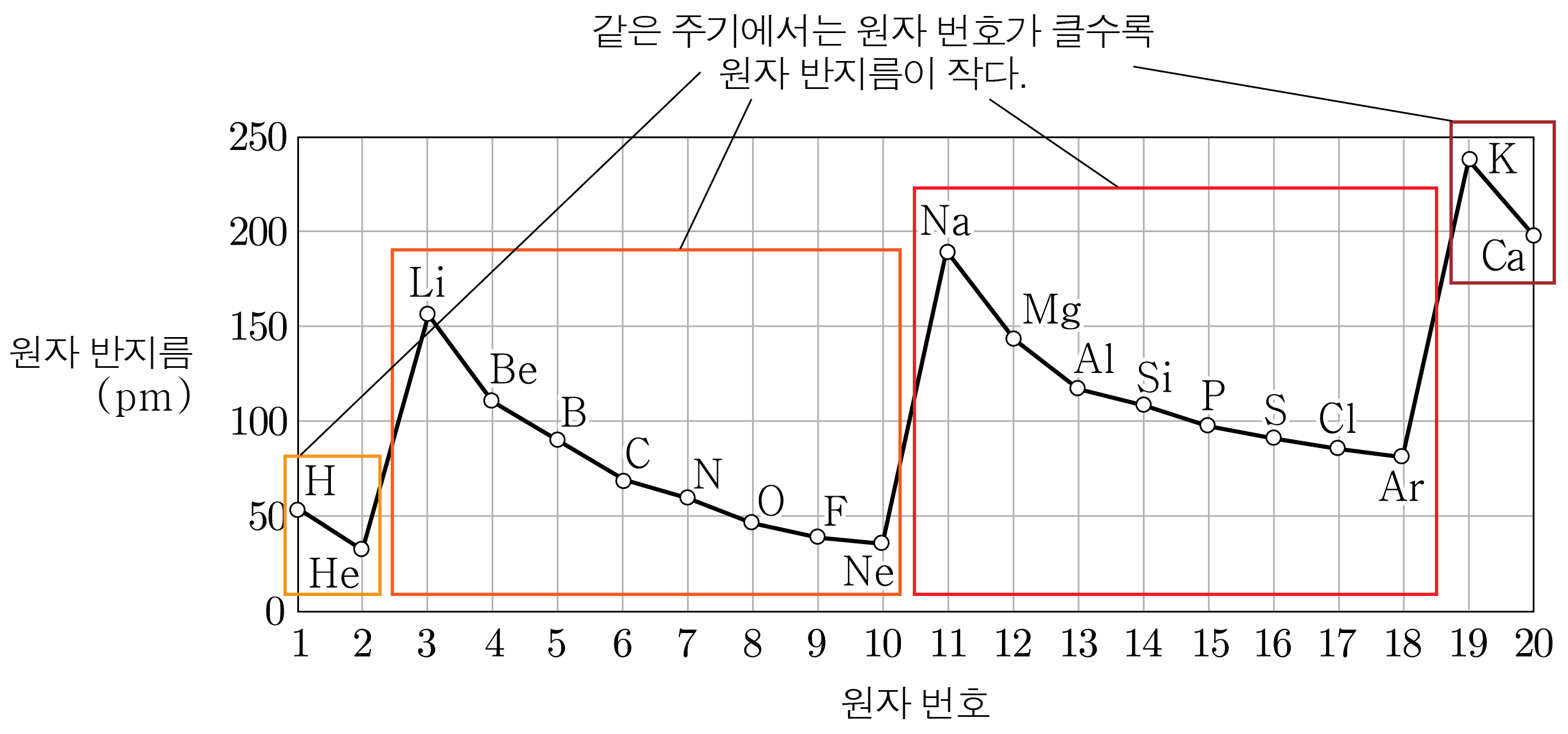
- 족 원소에서 다음 주기의 족 원소로 원자 번호가 증가할 때:
전자 껍질 수가 증가하여 원자 반지름이 급격히 커진다.
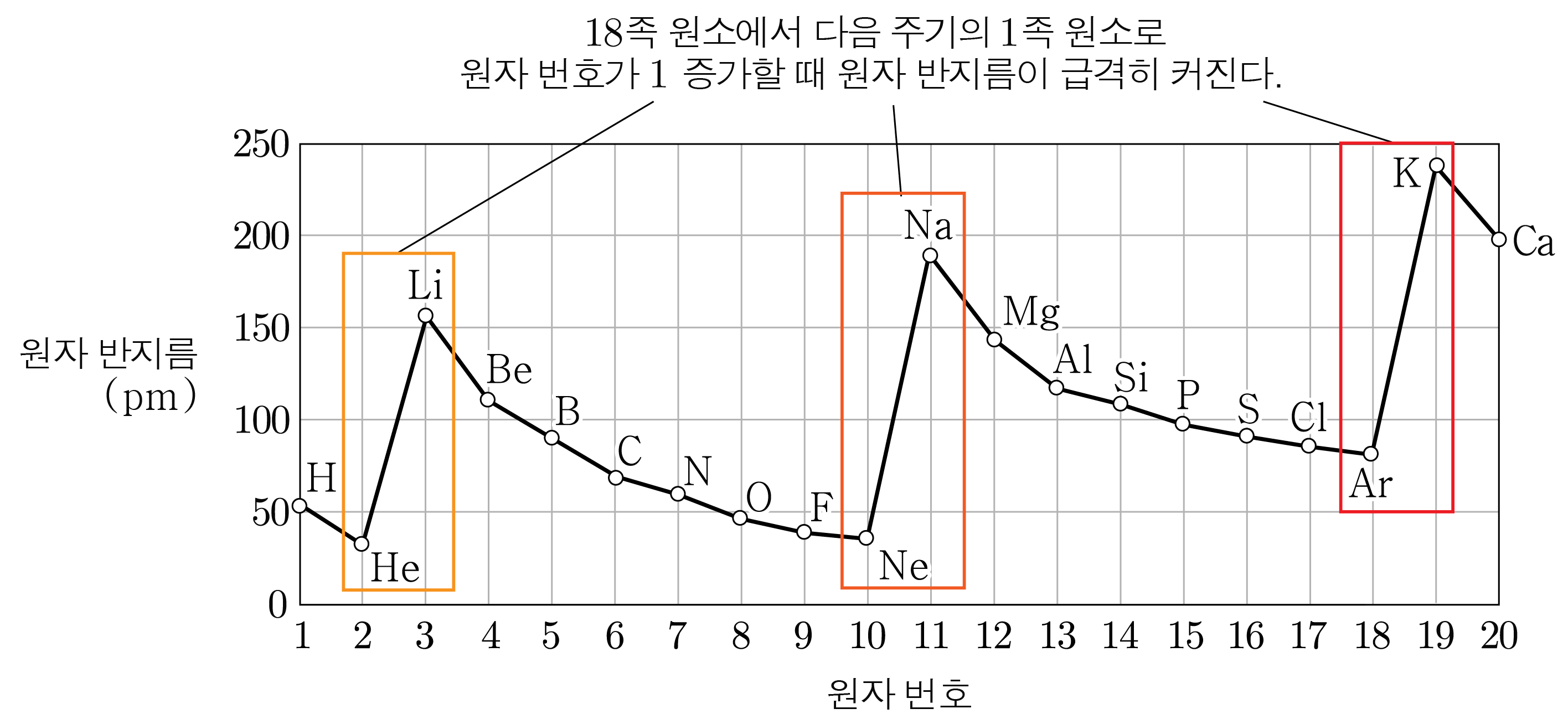
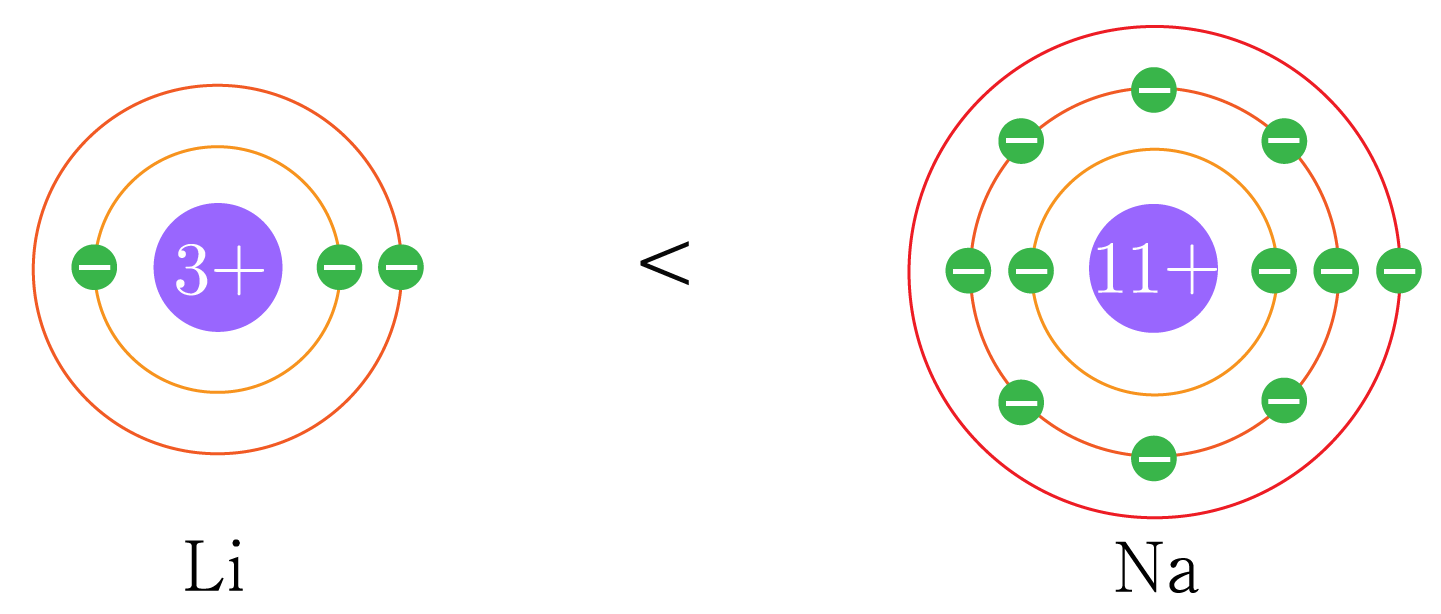
- 같은 족에서 원자 번호가 증가할 때:
전자 껍질 수가 증가하여 원자 반지름이 커진다.
예시) 족 원소의 원자 반지름 비교: $ \mathrm{Na}$
¶ 이온 반지름
인접한 같은 종류의 두 이온의 원자핵 사이 거리의 절반이다.
양이온은 전자를 잃어 전자 껍질 수가 감소하므로 이온 반지름이 원자 반지름보다 작다.
음이온은 전자 껍질의 수는 그대로지만 전자를 얻어 가려막기 효과 증가로
원자가 전자가 느끼는 유효 핵전하가 감소하므로 이온 반지름이 원자 반지름보다 크다.
¶ 이온 반지름의 비교
- 같은 족 원소의 이온 반지름 비교:
원자 번호가 클수록 전자 껍질 수가 증가하므로 이온 반지름이 커진다.
예시) 족 원소의 이온 반지름 비교: $ \mathrm{Na^+}$
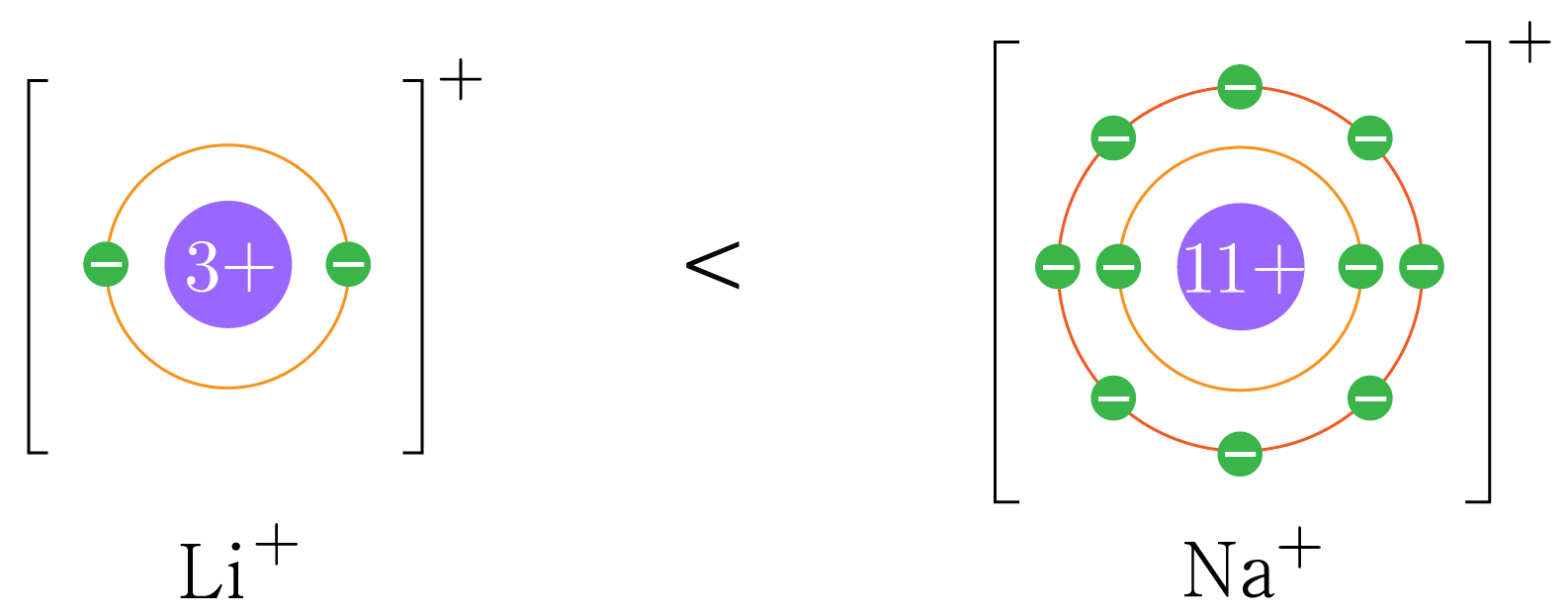
예시) 족 원소의 이온 반지름 비교: $ \mathrm{Cl^-}$
-
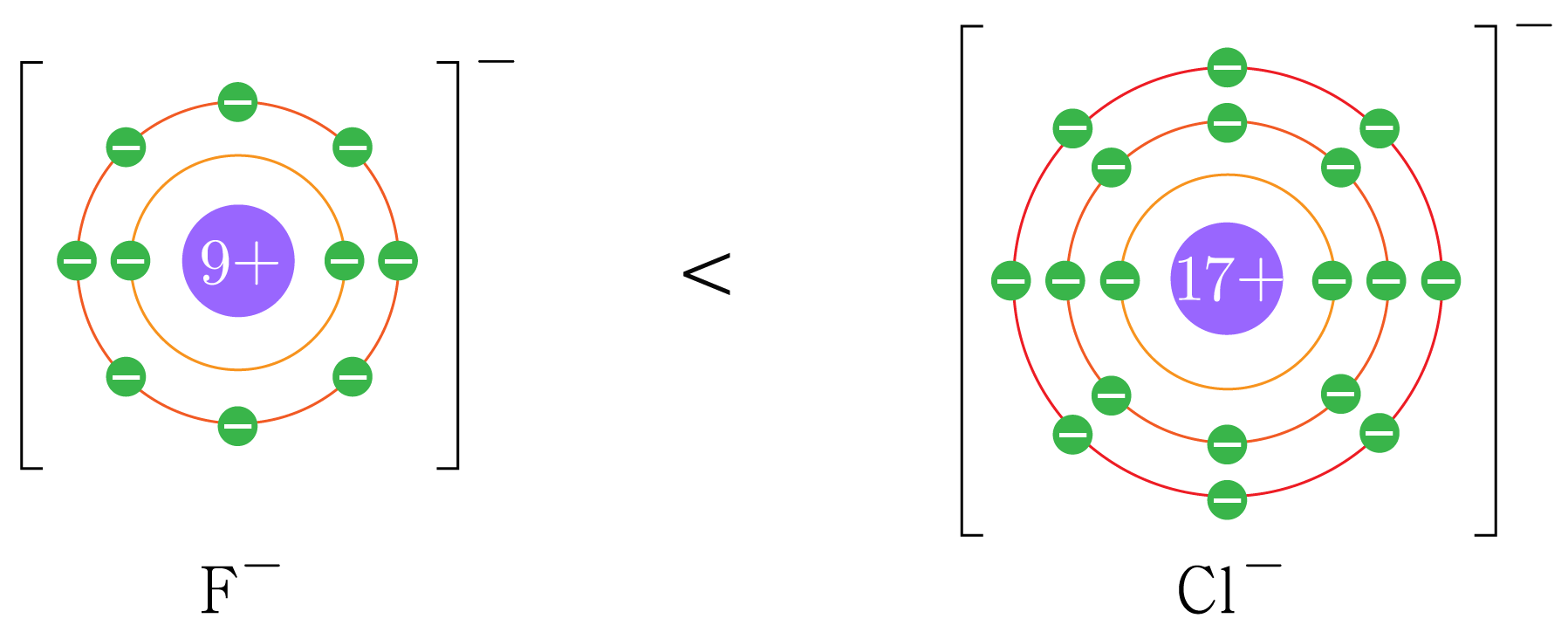
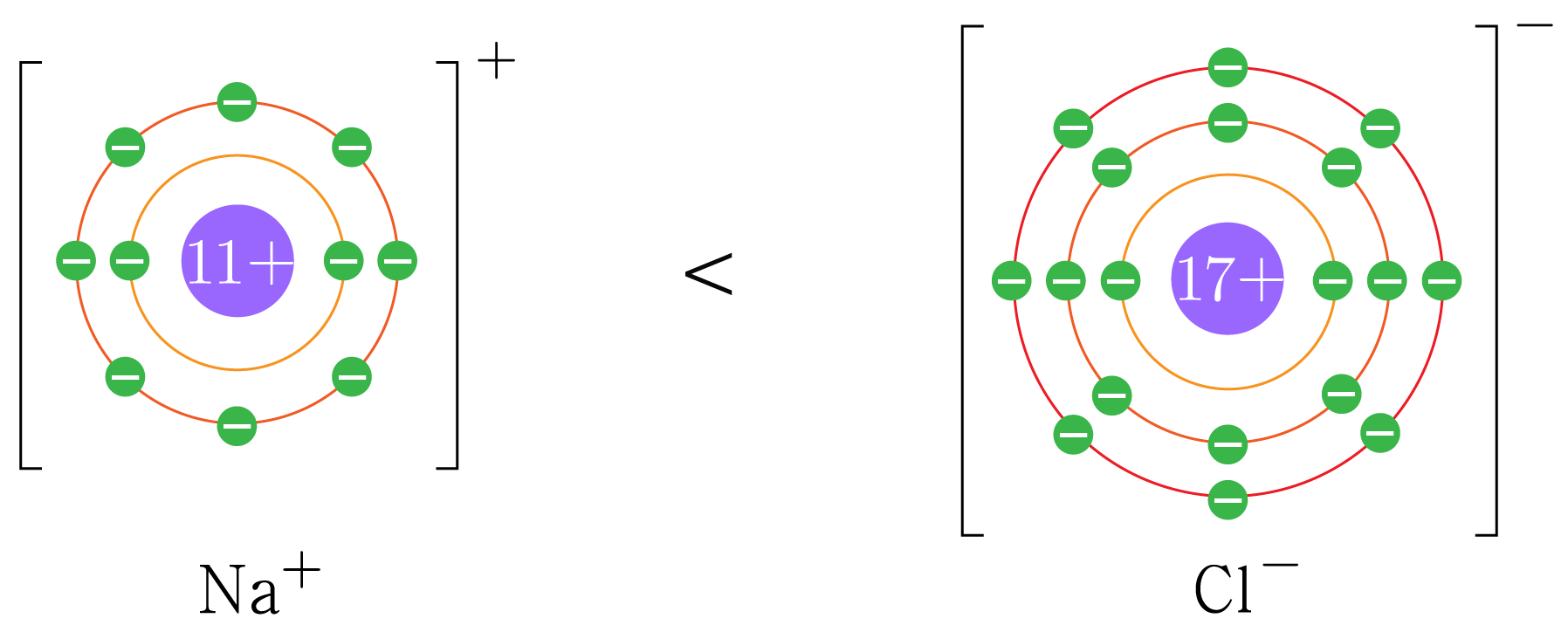
같은 주기 원소의 양이온과 음이온 반지름 비교:
양이온은 같은 주기 원소의 음이온보다 전자 껍질이 적어 반지름이 작다.예시) 주기 원소의 이온 반지름 비교: $ \mathrm{Cl^-}$
-
전자 수가 같은 이온의 이온 반지름 비교:
원자 번호가 클수록 유효 핵전하가 크므로 이온 반지름이 작다.예시) 전자 수가 네온()과 같은 원소의 이온 반지름 비교:
$ \mathrm{O^{2-}}$
¶ 적용 문항
¶ 1번 문항

정답: $5$
ㄱ. 전자 수가 같은 이온은 원자 번호가 클수록 유효 핵전하가 커 이온 반지름이 작으므로
이온 반지름은 이다.
따라서 , , 는 각각 , , 이며, 는 금속 원소이다. (O)
ㄴ. 같은 주기에서 원자가 전자가 느끼는 유효 핵전하는 원자 번호가 클수록 크므로 가 보다 작다. (O)
ㄷ. 족 원소에서 다음 주기의 족 원소로 원자 번호가 증가할 때 전자 껍질 수가 증가하여 원자 반지름이 급격히 커진다.
그러므로 원자 반지름은 가 보다 작다. (O)
따라서 답은 번이다.
¶ 2번 문항
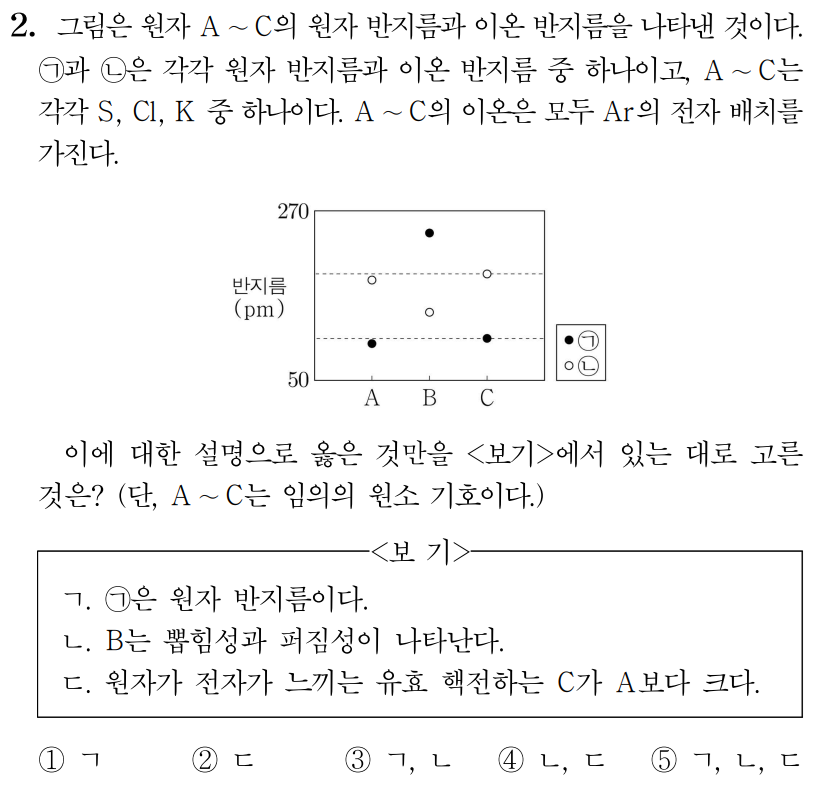
정답: $3$
ㄱ. 와 은 이온이 될 때 음이온이 되므로 이온 반지름이 원자 반지름보다 크고,
는 이온이 될 때 양이온이 되므로 이온 반지름이 원자 반지름보다 작다.
그러므로 ㉠()은 원자 반지름, ㉡()은 이온 반지름이다. (O)
ㄴ. 는 이온 반지름()이 원자 반지름()보다 작으므로 이며, 는 금속 원소로 뽑힘성과 퍼짐성이 나타난다. (O)
ㄷ. 같은 주기에서 원자 번호가 증가할 때 전자 껍질의 수는 그대로지만 원자가 전자가 느끼는 유효 핵전하가 증가하여 원자 반지름이 작아진다.
그러므로 원자 반지름은 이고, 원자가 전자가 느끼는 유효 핵전하는 이다.
이때 그래프에서 는 보다 원자 반지름()이 작으므로 , 는 각각 , 이고,
원자가 전자가 느끼는 유효 핵전하는 가 보다 작다. (X)
따라서 답은 번이다.


