¶ 지식 정보
¶ 분자 간 힘
분자 사이에 작용하는 힘이다.
종류는 쌍극자-쌍극자 힘, 분산력, 수소 결합이 있다.
분자 간 힘이 클수록 기준 끓는점(기압에서 액체가 기체로 바뀌기 시작하는 온도)이 높다.
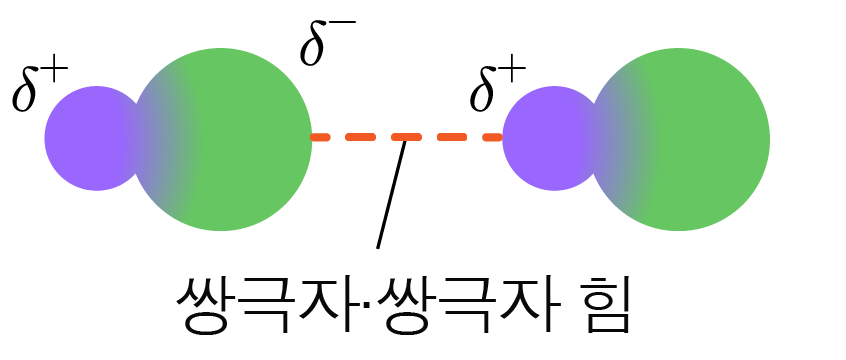
¶ 쌍극자-쌍극자 힘
극성 분자는 한 분자 내에서 부분적인 양전하()와 부분적인 음전하()를 띠는 영구 쌍극자를 가지는데,
이 영구 쌍극자에 의해 분자끼리 서로 끌어당기는 힘이다.
쌍극자-쌍극자 힘은 분자의 극성이 클수록 강하다.
¶ 분산력
분자 내에서 전자가 한쪽으로 치우쳐 순간적으로 쌍극자가 생기고, 이 쌍극자가 주위 분자에 쌍극자를 유도해서 생기는 힘이다.
전자가 한쪽으로 치우쳐 순간적으로 생긴 쌍극자는 순간 쌍극자,
순간 쌍극자에 의해 유도된 쌍극자는 유도 쌍극자라 한다.
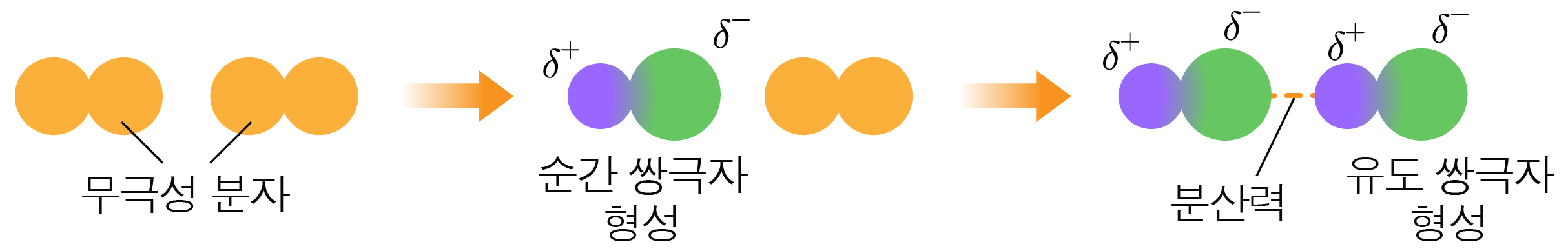
순간 쌍극자는 무극성 분자에도 생길 수 있기 때문에 분자의 극성에 관계없이 모든 분자는 분산력을 갖는다.
분자량이 크고 분자의 표면적(물체의 바깥쪽 표면의 넓이)이 넓을수록 분산력이 크다.
¶ 수소 결합
전기 음성도가 매우 큰 중 한 원소와 공유 결합한 (수소) 원자가 부분적인 양전하()를 띠어,
분자끼리 서로 강하게 끌어당기는 힘이다.
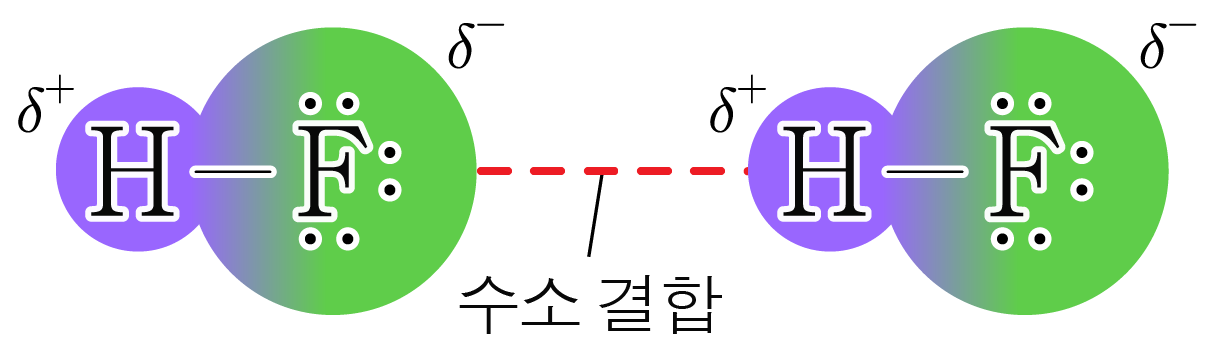
수소 결합은 분자 간 힘 중에서 매우 강한 편이지만, 공유 결합보다 약하다.
¶ 분자 간 힘 예시
표는 가지 분자의 분자량과 기준 끓는점을 나타낸 것이다. 이를 분자 간 힘을 통해 분석해보자.
| 분자 | $\mathrm{Cl_2}$ | $\mathrm{F_2}$ | $\mathrm{HCl}$ | $\mathrm{H_2O}$ |
|---|---|---|---|---|
| 분자량 | $71$ | $38$ | $36.5$ | $18$ |
| 기준 끓는점$(^\circ\mathrm{C})$ | $-34$ | $-188$ | $-85$ | $100$ |
- 와 의 기준 끓는점 분석:
분산력 비교:
와 의 분자량은 각각 이고, 분자량이 클수록 분산력이 크므로 분자 사이의 분산력은 가 보다 크다.
쌍극자-쌍극자 힘 비교:
와 는 모두 무극성 분자이므로 쌍극자-쌍극자 힘이 없다.
수소 결합 비교:
와 는 모두 중 한 원소와 공유 결합한 가 없으므로 분자 사이에 수소 결합이 없다.
따라서 분자 간 힘은 가 보다 강하고, 는 보다 기준 끓는점이 높다.
- 와 의 기준 끓는점 분석:
분산력 비교:
와 의 분자량은 각각 로 비슷하므로 분자 사이의 분산력은 비슷하다.
쌍극자-쌍극자 힘 비교:
는 무극성 분자이므로 쌍극자-쌍극자 힘이 없지만, 은 극성 분자로 쌍극자-쌍극자 힘이 있다.
수소 결합 비교:
와 은 모두 중 한 원소와 공유 결합한 가 없으므로 분자 사이에 수소 결합이 없다.
따라서 분자 간 힘은 쌍극자-쌍극자 힘에 의해 이 보다 강하며, 은 보다 끓는점이 높다.
- 과 의 기준 끓는점 분석:
분산력 비교:
과 의 분자량은 각각 이고, 분자량이 클수록 분자 사이의 분산력이 크므로 분산력은 이 보다 크다.
쌍극자-쌍극자 힘 비교:
과 는 모두 극성 분자로 쌍극자-쌍극자 힘이 있다.
수소 결합 비교:
과 중 만 중 한 원소()와 공유 결합한 가 있으므로 분자 사이에 수소 결합이 있다.
따라서 는 보다 분산력이 작지만 수소 결합으로 인해 분자 간 힘은 가 보다 강하고, 는 보다 기준 끓는점이 높다.
¶ 적용 문항
¶ 1번 문항
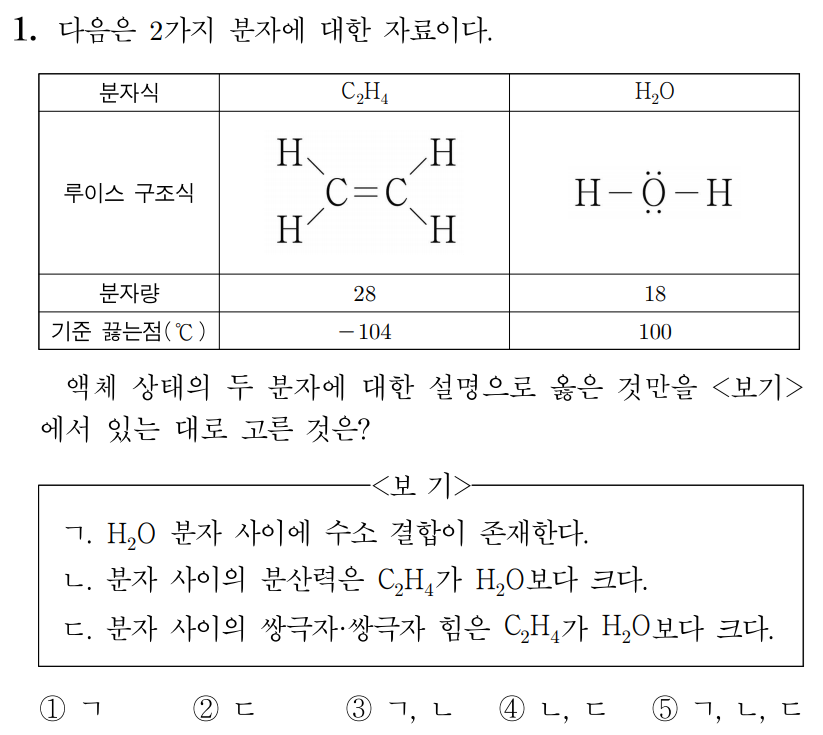
정답: $3$
ㄱ. 는 중 한 원소()와 공유 결합한 가 있으므로 분자 사이에 수소 결합이 있다. (O)
ㄴ. 분산력은 분자량이 크고 분자의 표면적이 넓을수록 크므로 분자 사이의 분산력은 가 보다 크다. (O)
ㄷ. 에서 각 원자는 평면 삼각형 구조를 가져 의 쌍극자 모멘트가 완전히 상쇄되므로 무극성 분자에 해당한다.
그러므로 는 쌍극자-쌍극자 힘이 없다.
는 극성 분자에 해당하므로 쌍극자-쌍극자 힘이 존재한다.
이를 통해 분자 사이의 쌍극자-쌍극자 힘은 가 보다 작음을 알 수 있다. (X)
따라서 답은 번이다.
¶ 2번 문항

정답: $4$
ㄱ. 는 중 한 원소()와 공유 결합한 가 있으므로 분자 사이에 수소 결합이 있다. (O)
ㄴ. 는 사면체 구조를 가져 쌍극자 모멘트가 완전히 상쇄되므로 무극성 분자에 해당한다.
그러므로 분자 사이에 쌍극자-쌍극자 힘이 존재하지 않는다. (X)
ㄷ. 는 와 같이 사면체 구조를 가져 쌍극자 모멘트가 완전히 상쇄되므로 무극성 분자에 해당한다.
또한 와 는 모두 중 한 원소와 공유 결합한 가 없으므로 분자 사이에 수소 결합이 없다.
그러므로 와 의 기준 끓는점의 차이는 분산력에 의해 생기는데,
분산력은 분자량이 클수록 크므로 기준 끓는점은 가 보다 높다.
이를 통해 임을 알 수 있다. (O)
따라서 답은 번이다.


