¶ 지식 정보
¶ 전자의 개수에 따른 원자의 에너지 준위
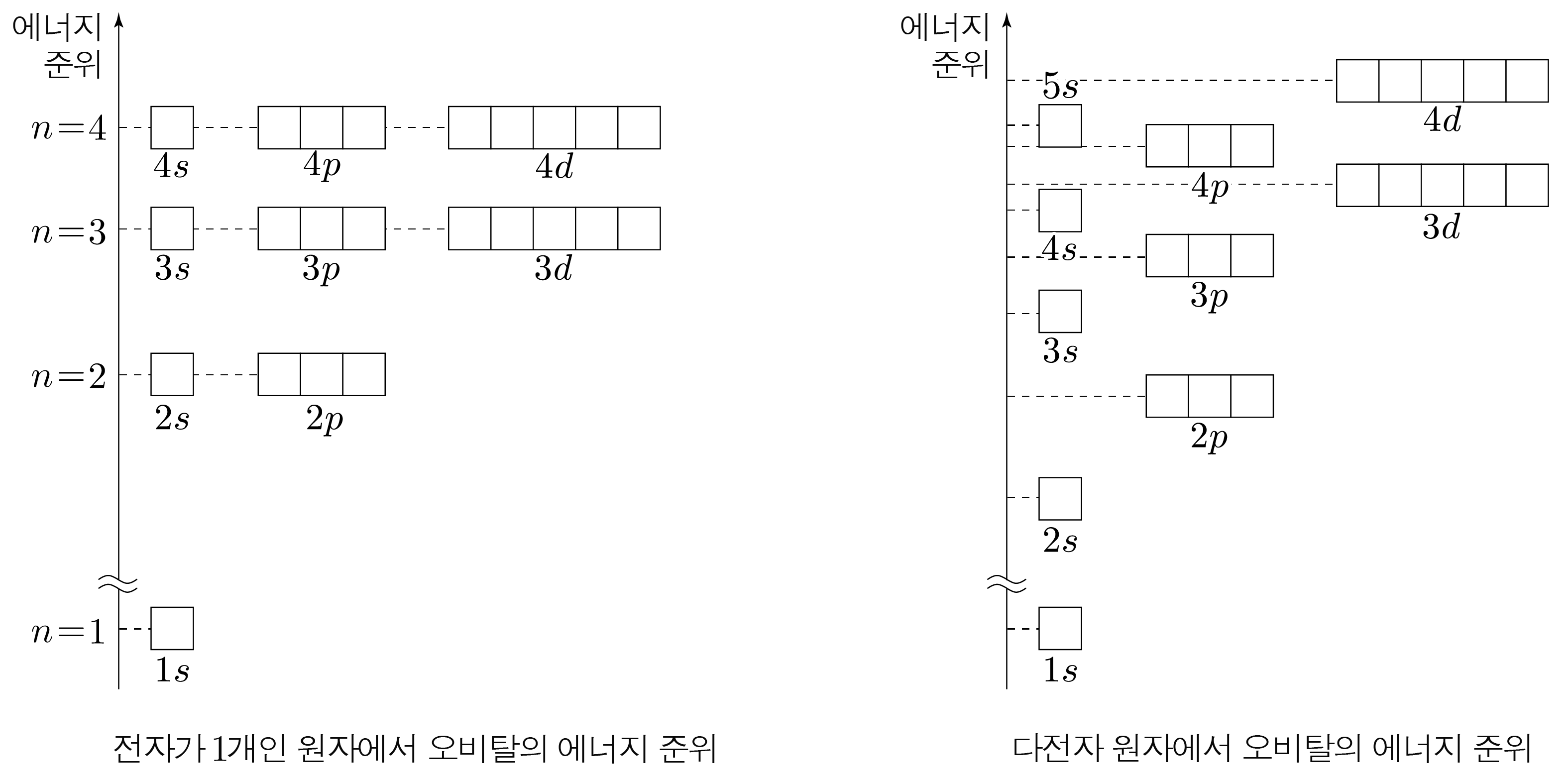
¶ 전자가 1개인 원자의 에너지 준위
전자가 개인 원자는 오비탈의 종류에 관계없이 주양자수에 의해서만 결정된다.
에너지 준위 비교:
¶ 다전자 원자의 에너지 준위
전자가 개 이상인 다전자 원자는 주양자수가 같더라도 오비탈의 종류에 따라 에너지 준위가 달라진다.
에너지 준위 비교:
임에 주의한다.
¶ 현대 원자 모형에서 전자 배치
쌓음 원리, 파울리 배타 원리, 훈트 규칙을 따른다.
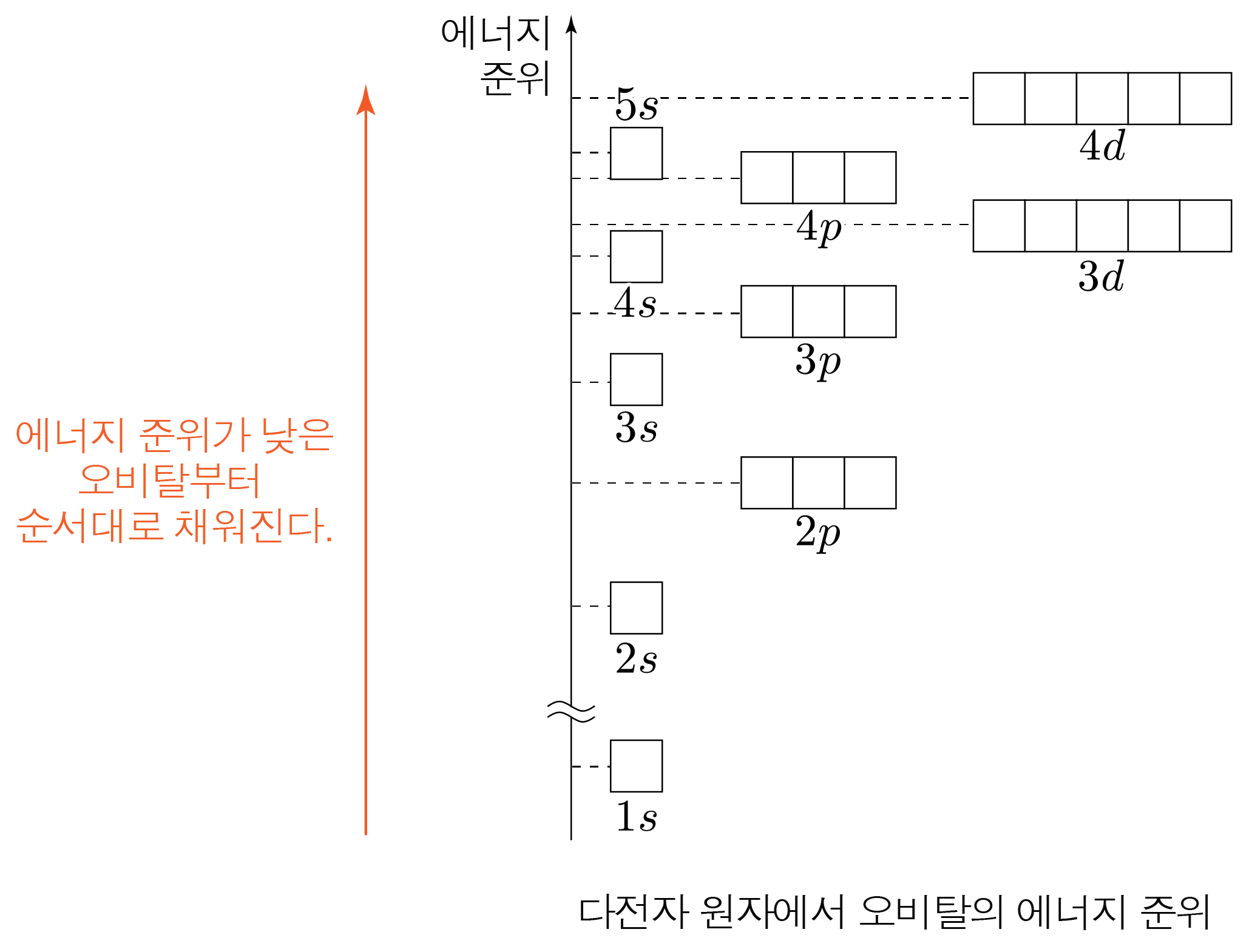
¶ 쌓음 원리
전자는 에너지 준위가 낮은 오비탈부터 순서대로 채워진다.
전자가 개 이상인 다전자 원자의 에너지 준위는
이므로
순으로 전자가 채워지다가 에 모든 전자가 채워지면, 에 전자가 채워지기 시작한다.
¶ 쌓음 원리 예시
칼슘()의 전자 배치 순서를 구해보자.
칼슘()은 원자 번호가 이고, 중성 원자이므로 개의 전자를 갖는다.
전자가 개 이상인 다전자 원자의 에너지 준위는
이므로
순으로 전자가 채워진다.
이때 오비탈에는 전자가 최대 개, 오비탈에는 전자가 최대 개까지 채워지므로, 전자 배치는
개 개 개 개 개 개와 같다.
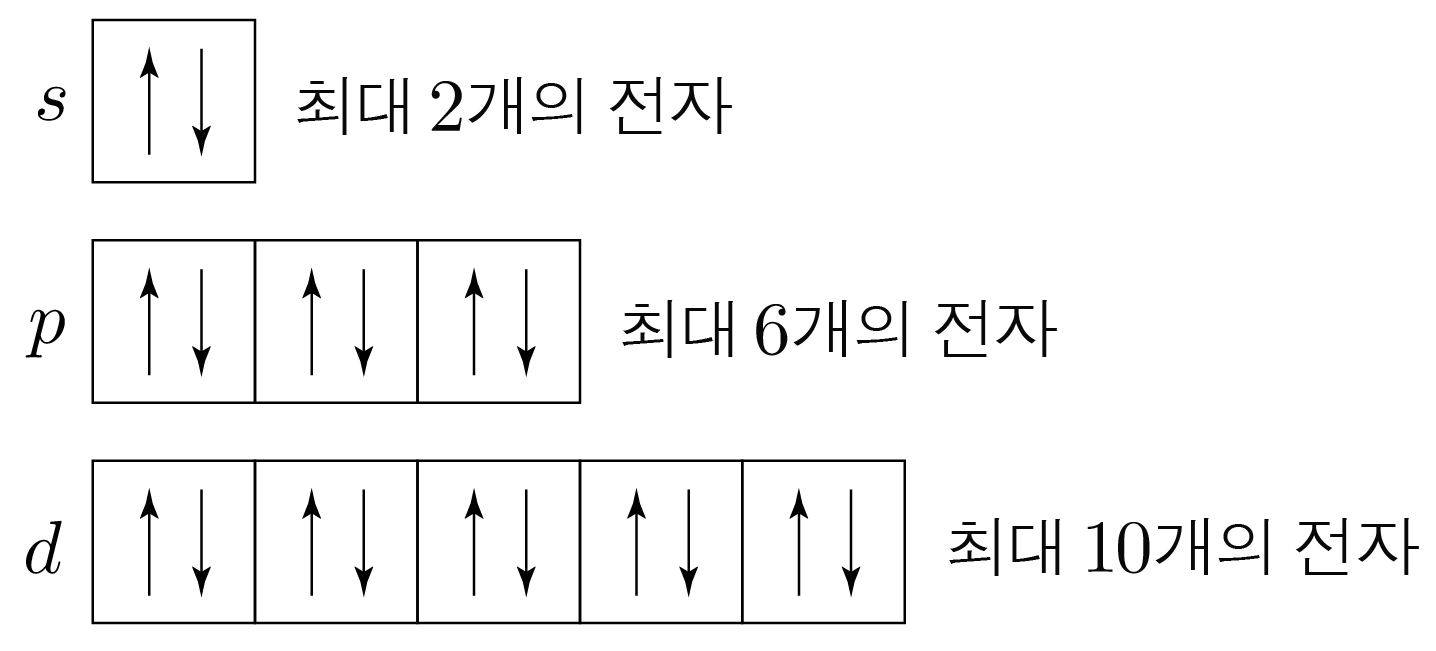
¶ 파울리 배타 원리
개의 오비탈에는 전자가 최대 개까지 채워지며, 이 두 전자는 서로 다른 스핀 자기 양자수를 갖는다.
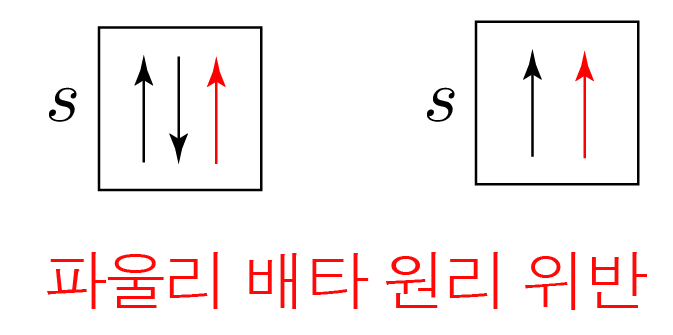
개의 오비탈에는 전자가 최대 개까지 채워지므로 개 이상은 들어갈 수 없으며,
개의 오비탈 내의 두 전자는 서로 다른 스핀 자기 양자수를 가지므로, 화살표의 방향은 서로 반대이다.
¶ 파울리 배타 원리 예시
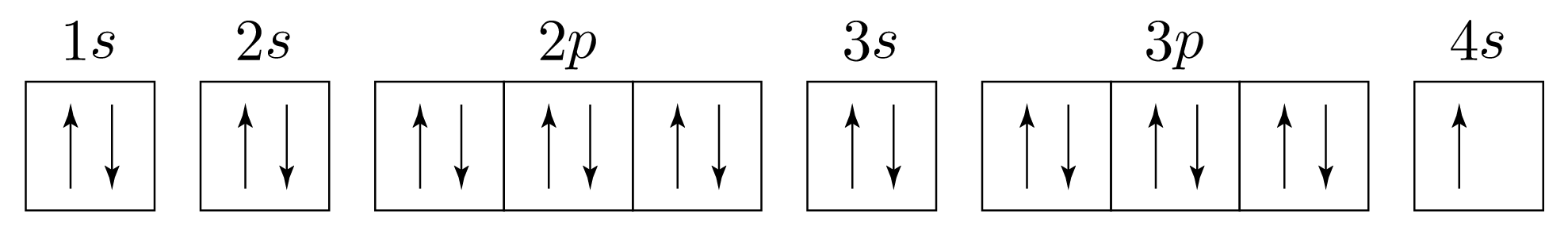
칼륨()의 전자 배치를 그려보자.
칼륨()은 원자 번호가 이고, 중성 원자이므로 개의 전자를 갖는다.
전자가 개 이상인 다전자 원자의 에너지 준위는
이므로
순으로 전자가 채워진다.
이때 오비탈에는 전자가 최대 개, 오비탈에는 전자가 최대 개까지 채워지므로, 전자 배치는
개 개 개 개 개 개와 같다.
따라서 전자 배치를 그림과 수식으로 나타내면 아래 그림과 같다.
- 그림으로 나타낼 때:
- 수식으로 나타낼 때:
¶ 훈트 규칙
에너지 준위가 같은 오비탈이 여러 개 있을 때, 전자는 쌍을 이루지 않는 전자(홀전자) 수가 최대가 되도록 배치된다.
¶ 훈트 규칙 예시
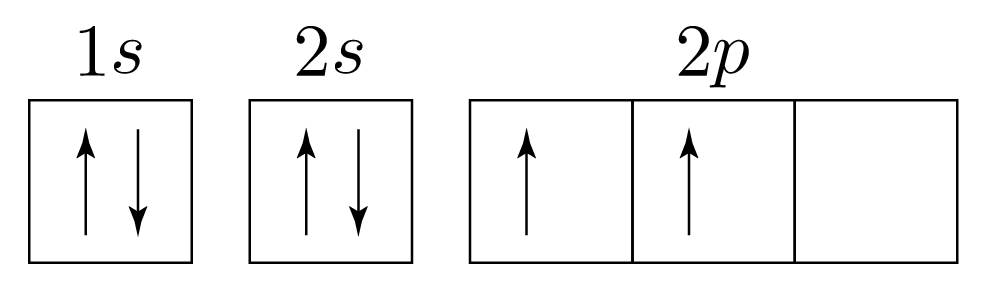
탄소()의 전자 배치를 그려보자.
탄소()는 원자 번호가 이고, 중성 원자이므로 개의 전자를 갖는다.
전자가 개 이상인 다전자 원자의 에너지 준위는
이므로
순으로 전자가 채워진다.
, 에 각각 전자가 개씩 채워지고, 에 나머지 전자 개가 채워질 때,
홀전자 수가 최대가 되도록 배치되므로 의 서로 다른 오비탈에 배치된다.
따라서 전자 배치를 그림과 수식으로 나타내면 아래 그림과 같다.
- 그림으로 나타낼 때:
- 수식으로 나타낼 때:
¶ 바닥상태와 들뜬상태
¶ 바닥 상태
쌓음 원리, 파울리 배타 원리, 훈트 규칙을 모두 만족한 상태이다.
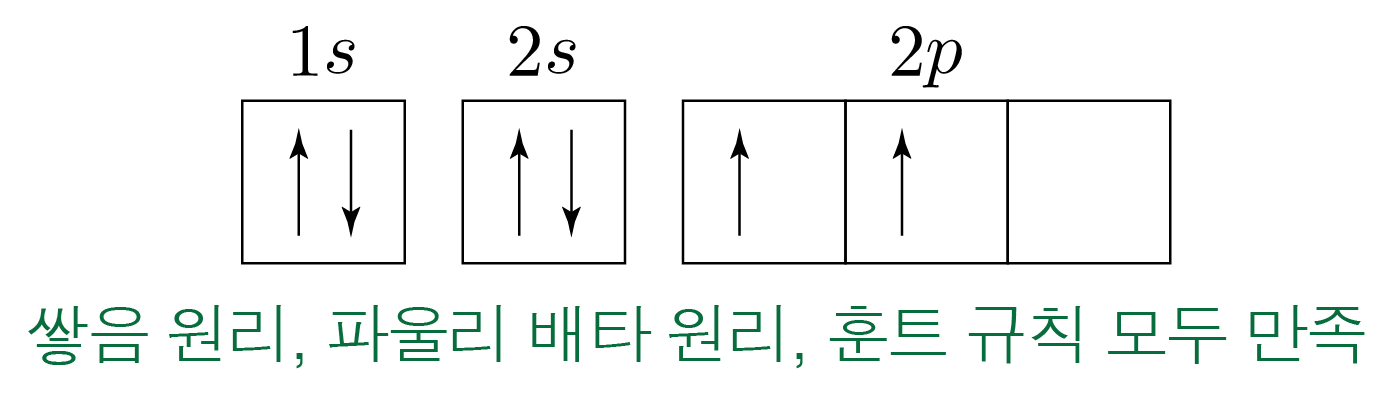
¶ 바닥 상태 예시
바닥 상태인 탄소 원자의 전자 배치를 나타내면 아래 그림과 같다.
¶ 들뜬 상태
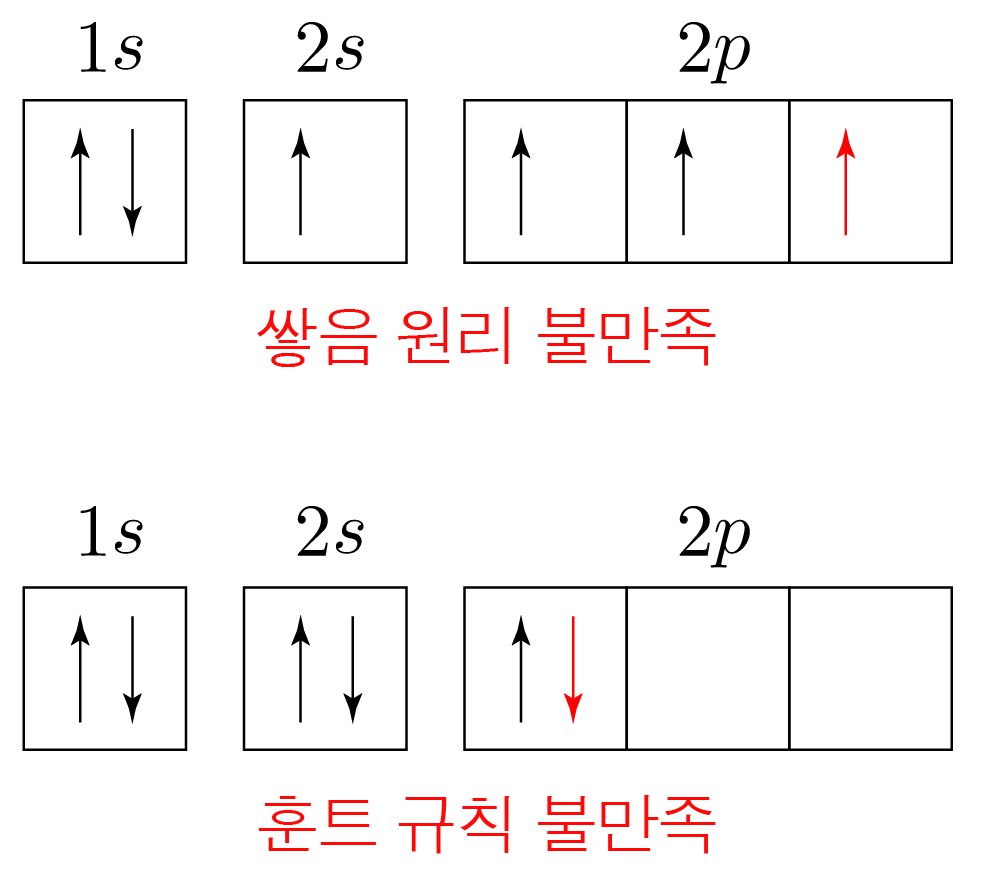
파울리 배타 원리는 만족하지만 쌓음 원리나 훈트 규칙을 만족하지 않는 상태이다.
¶ 들뜬 상태 예시
탄소 원자의 들뜬 상태의 전자 배치 예시를 나타내면 아래 그림과 같다.
¶ 적용 문항
¶ 1번 문항
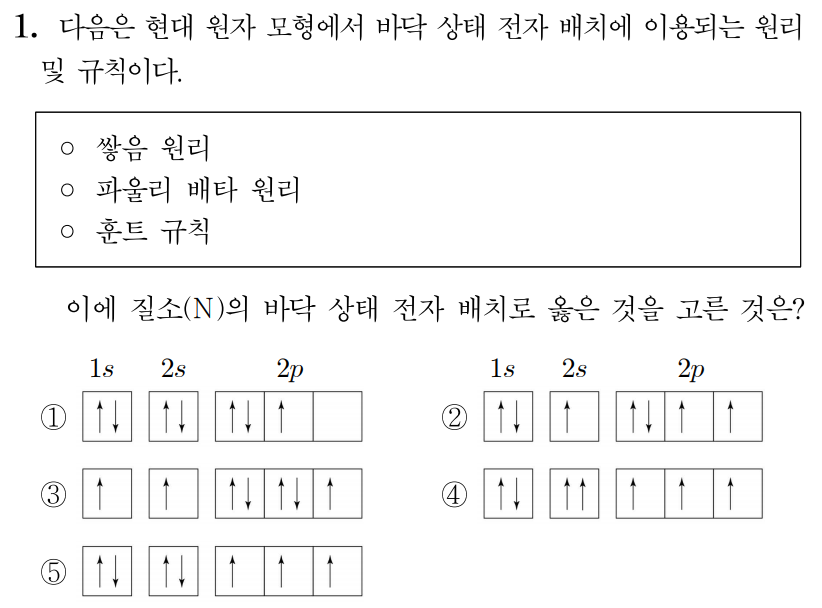
정답: $5$
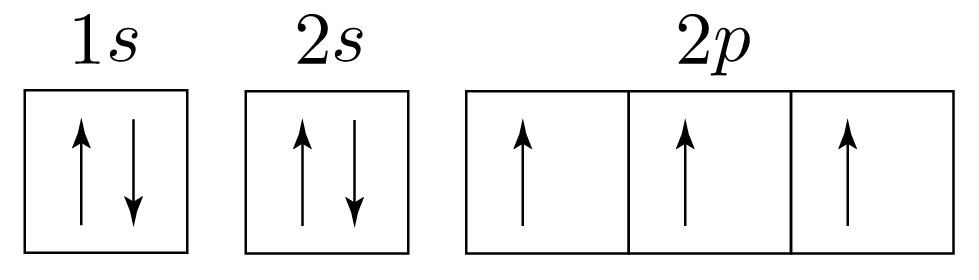
질소()의 바닥 상태 전자 배치를 그려보자.
질소()는 원자 번호가 이고, 중성 원자이므로 개의 전자를 갖는다.
전자가 개 이상인 다전자 원자의 에너지 준위는
이므로
순으로 전자가 채워진다.
, 에 각각 전자가 개씩 채워지고, 에 나머지 전자 개가 채워질 때,
홀전자 수가 최대가 되도록 배치되므로 의 서로 다른 오비탈에 배치된다.
그러므로 전자 배치를 그림으로 나타내면 아래 그림과 같다.
번은 의 전자가 서로 같은 방향이므로 파울리 배타 원리를 위반한다.
따라서 답은 번이다.
¶ 2번 문항

정답: $3$
ㄱ. 는 중성 원자이므로 양성자의 수는 전자의 수와 같다.
그림에서 전자는 개이므로 양성자는 개임을 알 수 있으며, 양성자의 수는 원자 번호와 같으므로
는 원자 번호가 인 플루오린()이다. (O)
ㄴ. 홀전자는 쌍을 이루지 않는 전자를 의미하므로 홀전자 수는 이다. (O)
ㄷ. 전자 배치는 쌓음 원리, 파울리 배타 원리, 훈트 규칙을 모두 만족하므로 바닥 상태이다. (X)
따라서 답은 번이다.


